| 폴리사카라이드 (POLYSACCHARIDE) 기반 면역활성제를 통한 백신 및 면역 치료제의 개발 | |
|---|---|
| Date 2024-04-29 18:40:49 |
|

교수 / 대학원생
인하대학교 생명과학과
ssejin@inha.ac.kr / nanojaeeun@inha.edu
1. 서론
면역시스템은 암, 바이러스 감염, 만성 면역질환, 자가 면역질환 등을 포함하는 거의 모든 질병의 발병과 진행에 중요한 역할을 수행한다. 따라서 질병과 연관된 면역세포를 타겟하여 활성을 조절하는 백신 및 면역치료제의 개발은 효과적인 질병 치료를 위한 차세대 의학적 접근법으로 대두하였다. RNA 기반 COVID 백신의 성공은 기존의 병원균 자체를 이용하여 제조하는 생백신 또는 사백신의 형태에서, 유전자, 단백질 및 펩타이드 항원을 기반으로 하는 "합성 백신”의 새로운 시대를 시작하는 계기가 되었지만, 안전성, 짧은 지속력 및 낮은 면역 활성의 극복이 필요하다. 이를 위하여 면역 반응을 선택적으로 조절 및 향상시킬 수 있는 “면역조절제” (immunoadjuvant)가 주목받고 있다.
효율적인 면역조절제의 개발을 위해 병원균이 체내에 감염을 일으키는 경로와 메커니즘에 주목할 필요가 있다. 특히 병원체 인식 수용체 (Pattern Recognition Receptor, PRR)에 의해 시작되는 선천면역계 (innate immunity)의 역할 및 기능에 대한 새로운 통찰이 필요하다 (그림 1). 병원균이 우리 몸 내부로 침입할 때 선천면역세포 표면의 PRR은 병원균 연관 분자 패턴 (Pathogen-Associated Molecular Pattern, PAMP)을 인지하여 면역반응을 시작한다 (PAMP-PRR 상호작용). 최근 많은 종류의 PRR이 보고되고 있으며 이러한 PRR은 다양한 면역세포의 표면 및 세포질 내부에 존재하며, PAMP를 인식하여 면역반응을 시작하고, T 세포 면역을 유도한다. 다양한 종류의 PAMP 물질 중 폴리사카라이드는 병원균 세포벽 물질의 약 90% 이상 (무게 중량 기준)을 차지하는 PAMP 물질로서 PRR 매개 면역반응을 유발한다고 알려져 있다. 최근 이러한 폴리사카라이드 기반 PAMP 물질을 면역조절제로 응용하는 다양한 사례들이 보고되고 있으며, 본 기고문에서는 폴리사카라이드의 면역 활성 기능을 소개하고 면역성을 증가시킬 수 있는 주요한 원리 및 전략을 통하여 백신 및 면역치료제 개발에 응용한 최신 연구동향을 소개하고자 한다.
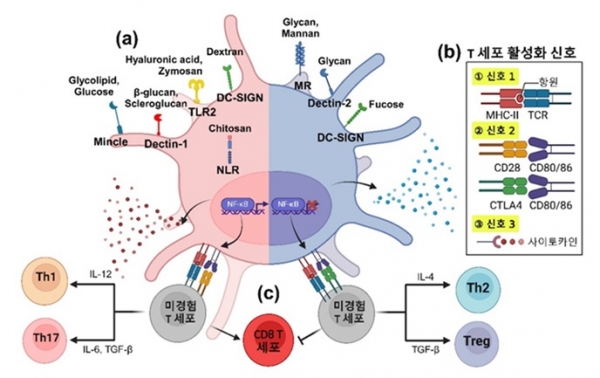
그림 1. 병원균 침입의 경로 및 메커니즘. 선천면역세포 표면의 PRR은 PAMP를 인지하여 면역반응을 시작한다 (PAMP-PRR 상호작용).
2. 본론
2.1. PAMP-PRR 상호작용: 병원균 침입에 대항하는 1차 방어 메커니즘
항원제시세포 (Antigen Presenting Cell, APC) 표면 및 세포질 내부에 존재하는 PRR은 다양한 형태의 PAMP 물질을 인지하고 T 세포 매개 면역을 유도한다 (그림 2a). 면역계의 주요 기능은 미생물이나 다른 외부 물질들이 침입하였을 때, 비자기 (non-self)를 우리 몸에 존재하는 자기 (self)와 명확하게 구분하여 알아내고 제거하여 개체를 보호하는 것이다. 이를 위해 면역계를 구성하는 세포와 분자들은 외부 감염물질이 가진 고유한 분자패턴을 정확하게 감지할 수 있다. 이러한 분자패턴은 “PAMP”로 알려져 있으며, 이들은 선천면역계 활성을 유도한다. PAMP는 플라겔린 (flagellin)과 같이 박테리아에서만 발견되는 단백질 및 RNA, 그리고 바이러스만이 가지고 있는 이중나선 RNA나 다양한 미생물에 존재하는 특이적인 분자들을 포함한다. PRR은 주로 세포 표면이나 내부에 위치하는 단백질 수용체로, PAMP를 특이적으로 감지함으로써 세포 내로 신호를 전달하여 면역반응을 촉진한다. C-타입 렉틴 수용체 (C-type Lectin Receptor, CLRs)는 가장 대표적인 폴리사카라이드 인식 PRR이며, Dectin-1, Dectin-2, DC-SIGN (Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin), Mincle (Macrophage‑inducible C‑type lectin), 만노스 수용체 (Mannose Receptor, MR) 등을 포함한다. CLR은 Dectin-1에 결합하는 베타글루칸 (β-glucan), MR 및 Dectin-2에 결합하는 글리칸(Glycan), DC-SIGN에 결합하는 덱스트란 (Dextran) 등의 폴리사카라이드와 PAMP-PRR 상호작용하여 염증성 사이토카인 방출 및 T 세포 분화를 유발한다. 톨유사 수용체 (Toll-like Receptor, TLRs)는 세포 표면 및 엔도좀에서 발현되는 PRR로, 특히 TLR-2는 베타글루칸을 인식하여 2차 감염을 막는 1형 인터페론 (type 1 inteferon, IFN) 생성을 유도한다. NOD-유사 수용체 (Nucleotide-binding Oligomerization Domain-like Receptor, NLRs)는 세포질에 존재하는 PRR로, NF-κB (Nuclear Factor kappa B)을 활성화시키는 효소 RIP-2 (Receptor interacting protein-2)을 유도하거나, 단백질 분해 효소 caspase를 통해 IL-1β 및 IL-18 사이토카인을 생산한다. 병원균 세포벽의 주요 구성 성분들 - 단백질, 리포단백질 (lipoprotein), 폴리사카라이드, 리포폴리사카라이드 (lipopolysaccharide) - 과 같은 물질들은 병원균의 형태와 구조를 유지하고 생존과 병원성 유발에 중요한 역할을 하며, 기본적으로 PAMP로 작용할 수 있다. 주목할 만한 점은 폴리사카라이드의 화학적 특성에 따라 다른 면역반응이 유발될 수 있다는 것이다 [1]. 여러 연구에 의하면, 만난 (Mannan)은 호중구 및 대식세포 분화 효과가 있으며 [2], 키토산 (Chitosan)은 1형 인터페론과 항염증 인자인 IL-1Ra (Interleukin-1 receptor antagonist protein)의 방출을 유도한다 [3]. 히알루론산 (Hyaluronic acid)은 호중구를 활성화시키고 [4], 자이모산 (Zymosan)은 NF-κB를 활성화시켜 전염증성 사이토카인을 분비한다고 보고되었다 [5].
이처럼 폴리사카라이드-PAMP 물질은 PRR과의 상호작용을 통하여 다음과 같은 과정으로 면역반응을 시작하여 T 세포 면역을 유발한다 (그림 2b, T 세포 활성화 신호); 신호 1) APC 내부에서 처리되어 주조직 적합성 복합체 (Major Histocompatibility Complex, MHC) 분자에 제시된 항원을 T 세포 수용체 (T Cell Receptor, TCR)가 인식하는 과정; 신호 2) APC의 공동자극수용체 (CTLA4, CD28 등)와 T 세포 표면에 발현되는 공동자극분자 (CD80/CD86)간 상호작용을 통한 면역반응의 균형을 조절하는 과정; 신호 3) 신호 2에 의해 유도되는 NF-κB 중심 사이토카인 분비를 통한 다양한 T세포의 분화를 조절하는 과정과 관련이 있다. 세 가지 신호들은 T 세포 활성화 및 B 세포의 항체 생성 등 다양한 메커니즘을 유도하며, 재감염 방지를 위해 병원균에 대한 장기 기억을 가지게 하여 면역반응을 조절한다 (그림 2c). 이러한 신호들을 균형 있게 조절하는 것은 원하는 치료효과를 유발하면서도 자가 면역질환과 같은 면역계 이상 반응과 같은 부작용을 최소화할 수 있다.
그림 2. T 세포 활성화 신호 3가지 모식도. 신호 1: TCR과 항원-MHC 분자의 상호작용. 신호 2: T 세포의 공동자극수용체와 APC의 공동자극분자 간 상호작용. 신호 3: 사이토카인 분비.
2.2. 폴리사카라이드 면역 활성을 증가시킬 수 있는 전략의 소개
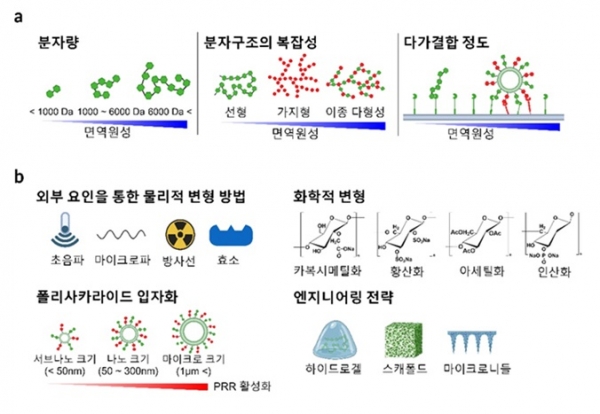
폴리사카라이드의 면역 활성을 증가시키는 주요 요인으로는 분자량, 분자 구조의 복잡성과 종류 (다형성 및 이질성), 결합력 (avidity)과 다가 결합 (multivalence)이 포함된다 (그림 3a). 일반적으로 폴리사카라이드의 분자량이 높을수록 면역 활성이 강하다. 분자량이 1 kDa 미만인 경우 면역 활성이 없고, 6 kDa를 초과하는 경우 면역을 유발할 수 있는 것으로 보고되고 있다 [6]. 또한 선형일 때 비하여 분지 (branched)를 많이 가질수록 (다형성), 그리고 두 종류 이상의 다양한 단당류 (monosaccharide) 단위체로 구성되었을 경우 (이질성) 폴리사카라이드의 분자 구조 복잡성이 증가되며 면역 활성이 증가된다. 특히 최근 밝혀진 주목할 만한 사실은, 여러 개의 PAMP 물질이 상응하는 여러 개의 PRR 과의 다가 결합을 통하여 동시에 상호작용할 경우 (Multivalent PAMP-PRR interaction), 다양한 세포 내 신호 경로들 간의 시너지를 통하여 매우 강력한 면역반응이 유도된다는 것이다.
이와 같은 폴리사카라이드 면역 활성에 영향을 미치는 여러 요인들을 기반으로 다양한 엔지니어링 전략을 통하여 폴리사카라이드 면역 활성의 세밀한 조절이 가능하다 (그림 3b). 1) 외부 요인을 통한 물리적 변형 방법: 초음파 처리, 마이크로파 노출, 방사선 처리, 효소 분해 등으로 고분자 폴리사카라이드를 절단하여 용해도와 유연성이 향상된 저분자 물질로 개질이 가능하다; 5~10 kDa 저분자 베타글루칸은 면역학적으로 비활성인 것에 반하여, 100~200 kDa 범위의 고분자 베타글루칸은 식균작용 및 항균 활성과 관련하여 면역학적으로 높은 활성을 가진 것으로 보고되었다 [7]; 2) 화학적 변형 방법: 폴리사카라이드의 형태 및 구성에 변화를 유도할 수 있다. 이러한 화학적 변형은 폴리사카라이드에 구조적 다양성을 부여하고 생물∙면역학적 활성을 향상시킨다. 특히, 카복시메틸화와 황산화는 폴리사카라이드에 음전하를 부여하고, 아세틸화와 인산화는 폴리사카라이드에 소수성을 부여해 수용성을 개선시킬 수 있다; 3) 입자화 방법: 폴리사카라이드의 입자화를 통하여 입자 외부 표면에 폴리사카라이드-PAMP를 고밀도로 집적하여 제시할 수 있으며 이를 통하여 다가 결합 PAMP-PRR 상호작용을 유도할 수 있다. 본 연구그룹은 표면에 폴리사카라이드 만난이 고밀도로 집적된 나노입자를 개발하였으며, 이를 통하여 APC 표면의 PRR (Dectin-2 및 TLR-4)들과의 다가 결합 상호작용에 의하여 비약적으로 증가된 면역 활성을 보였으며, 종양 미세환경 하에서 Th17 (T helper 17 cells) 반응을 유도하여 강력한 항암 효과를 입증하였다 [8]. 나노입자뿐만 아니라 폴리사카라이드 기반 하이드로겔, 스캐폴드 및 마이크로니들과 같은 제형들도 향상된 면역 활성을 부여하면서도 뛰어난 약물 방출 제어 능력을 제공할 수 있음이 보고되고 있다 [9].
그림 3. 폴리사카라이드 면역 활성 조절 전략 소개. A: 높은 분자량, 구성과 구조의 복잡성 및 분지 정도, 폴리사카라이드 입자화는 면역 활성을 향상시킨다 (면역 활성 조절 주요 원리). B: 외부 요인을 통한 물리적 변형, 화학적 변형, 입자화 같은 전략은 보다 확장 가능한 시스템을 제공한다 (엔지니어링 전략).
2.3. 폴리사카라이드 기반 면역치료제로의 응용: 백신 (Vaccine) 기술
백신은 인체에 접종하여 병원균에 대한 면역력을 강화시키는 물질로, 체내 면역시스템이 특정 질병을 기억하게 하여 실제 병원균이 침입했을 때 빠르고 효과적인 면역반응을 유도한다. 백신의 주요 구성 성분은 항원과 보조제이며, 이 중 항원은 APC에 의해 감지되어 세포 표면에 제시되는 물질로서 단백질, 펩타이드, RNA 등이 사용될 수 있다. 한편 면역보조제는 항원과 함께 사용되어 면역반응을 강화시키는 지속력을 높여주는 역할을 하며 주로 병원균 유래 물질인 DNA, RNA, 자연유래물질, 및 저분자 등이 사용될 수 있다.
백신은 근육 및 피하 주사로 체내로 주입되어 APC에 의해 포식되어 작용하지만, 체내에서의 짧은 반감기와 비효율적인 약동학적 거동으로 인하여 사용에 제한이 많다. 백신의 나노화 (나노백신)는 백신의 한계를 극복하고 효능을 향상시킬 수 있는 효과적인 방법이다. 나노백신은 입자의 크기가 조절이 가능하고, 항원 및 보조제의 우수한 함유 효율, 뛰어난 체내에서의 약물 방출 및 약동학적 특성 등 여러 장점을 제공한다. 또한, 20~50 nm 직경의 나노백신은 생물학적 장벽을 쉽게 통과하여 백신 작용의 가장 중요한 기관인 림프절에 축적될 수 있다 [8]. 나노백신은 주로 근육 및 피하주사 방식으로 주입될 수 있으며 다음과 같은 방식으로 치료 효과를 나타낼 수 있다 (그림 4); 체내로 주입된 나노백신은 림프절로 이동하여 APC 내로 포식되고, 세포질에서 항원을 방출하거나 (단백질 또는 펩타이드 항원) 항원을 생산하게 되고 (mRNA 항원), 이후 항원이 분해되는 처리 과정을 거쳐 APC 표면에 MHC 분자와의 결합을 통해 항원을 제시한다. 제시된 항원은 TCR에 의해 T 세포에 인식되어 T 세포의 항원 특이적 면역 활성을 유도하게 된다 (T cell crosspriming 과정). 이 때, 나노백신에 함유된 보조제는 위에서 언급한 공동자극신호 (신호2)의 발현을 유도하여 강력하고 지속적인 T 세포의 활성을 유도하는 데 필수적인 역할을 한다.
백신의 보조제는 PRR과의 상호작용을 통하여 APC를 활성화시켜 공동자극신호를 발현하고 사이토카인을 방출하여 강력한 T 세포의 면역반응을 유도하는 데 중추적인 역할을 한다. 현재 사용되고 있는 면역활성능력이 뛰어난 면역보조제 중에서 폴리카사라이드는 면역 조절 특성, 생체 분해성, 생체 적합성, 낮은 독성 및 안전성을 가지고 있어 백신의 면역보조제로 사용하기에 적합하여 백신 제조 분야에서 주목을 받으며 개발이 활발히 진행되고 있다. 백신에서 폴리사카라이드의 가장 일반적인 응용 분야 중 하나는 나노입자다. 키토산은 SARS-CoV2를 표적으로 하는 나노입자 기반 백신에 사용되어 항체 생산을 증가시키고 바이러스로부터 보호하는 능력을 가지고 있다는 연구 결과가 있다 [10]. 본 연구그룹에서 개발한 만난 및 덱스트란 나노 캡슐을 활용한 mRNA 백신은 DC, 대식세포 및 골수유래 세포와 같은 다양한 면역세포를 표적화하여 mRNA를 전달하였고, 특히 만난 mRNA 백신은 Dectin-2와 TLR-4 PRR 의존적인 방식으로 항종양 효과를 나타냈다 [2]. 이러한 다양한 연구들은 폴리사카라이드 기반 백신의 주목할 만한 접근 방식을 보고하고 있다. 하지만 여전히 폴리사카라이드는 낮은 면역 활성, 복잡한 정제 과정, 단백질 접합의 어려움 등의 한계가 존재하며 본 기고문에서 제안하는 다양한 전략들을 통하여 이러한 한계점들을 극복할 수 있을 것이다.
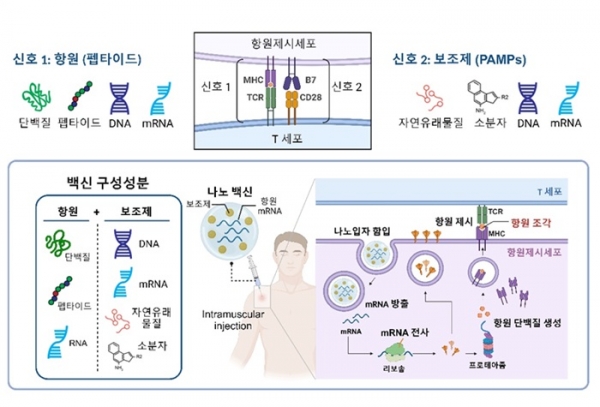
그림 4. 백신 기술과 나노백신의 작용 기작. 백신은 항원과 보조제로 구성되며 병원균에 대한 강력한 면역반응을 유도한다.
3. 결론
폴리사카라이드는 병원체의 세포벽을 구성하는 주요 물질이며, 인체 내에 유입되었을 경우, 면역반응을 유발하는 물질로서 최근 폴리사카라이드 기반 면역치료제 관련 연구는 많은 관심을 받고 있다. 폴리사카라이드는 PAMP로써 작용하여 면역세포와 PAMP-PRR 상호작용을 통해 면역반응 조절에 탁월한 효과를 발휘할 수 있다. 폴리사카라이드 종류 및 기원에 따라 서로 다른 면역반응이 유발되기 때문에 병원균 식별에 용이하고 질병 치료에 면역반응을 비약적으로 촉진시킬 수 있다. 다양한 연구를 통해 폴리사카라이드의 특성과 작용 메커니즘을 깊이 이해하고, 이를 기반으로 한 새로운 면역치료제의 개발은 면역질환 환자들에게 새로운 희망을 제공할 수 있을 것이다.
참고문헌
1. Lin, K., & Kasko, A. M. (2014). Carbohydrate-Based Polymers for Immune Modulation. ACS macro letters, 3(7), 652–657.
2. Son, S., Nam, J., Zenkov, I., Ochyl, L. J., Xu, Y., Scheetz, L., Shi, J., Farokhzad, O. C., & Moon, J. J. (2020). Sugar-Nanocapsules Imprinted with Microbial Molecular Patterns for mRNA Vaccination. Nano letters, 20(3), 1499–1509.
3. Fong, D., & Hoemann, C. D. (2017). Chitosan immunomodulatory properties: perspectives on the impact of structural properties and dosage. Future science OA, 4(1), FSO225.
4. Meteva, D., Vinci, R., Seppelt, C., Abdelwahed, Y. S., Pedicino, D., Nelles, G., Skurk, C., Haghikia, A., Rauch-Kröhnert, U., Gerhardt, T., Straessler, E., Zhao, Y., Golla, F., Joner, M., Rai, H., Kratzer, A., Arnal, H. G., Liuzzo, G., Klotsche, J., Crea, F., … Kränkel, N. (2023). Toll-like receptor 2, hyaluronan, and neutrophils play a key role in plaque erosion: the OPTICOACS study. European heart journal, 44(38), 3892–3907.
5. Sato, M., Sano, H., Iwaki, D., Kudo, K., Konishi, M., Takahashi, H., Takahashi, T., Imaizumi, H., Asai, Y., & Kuroki, Y. (2003). Direct binding of Toll-like receptor 2 to zymosan, and zymosan-induced NF-kappa B activation and TNF-alpha secretion are down-regulated by lung collectin surfactant protein A. Journal of immunology (Baltimore, Md: 1950), 171(1), 417–425.
6. Coico, R. (2021). Immunology: A Short Course.
7. John A. Bohn, James N. BeMiller. (1995). (1→3)-β-d-Glucans as biological response modifiers: a review of structurefunctional activity relationships. Carbohydrate Polymers, Volume 28, Issue 1, 3-14.
8. Son, S., Nam, J., Kim, A. S., Ahn, J., Park, K. S., Phoo, M. T., Sherren, B., Zou, W., Lee, S. H., Farokhzad, O. C., Shi, J., & Moon, J. J. (2023). Induction of T-helper-17-cell-mediated anti-tumour immunity by pathogen-mimicking polymer nanoparticles. Nature biomedical engineering, 7(1), 72–84.
9. Goldberg M. S. (2019). Improving cancer immunotherapy through nanotechnology. Nature reviews. Cancer, 19(10), 587–602.
10. Tabynov, K., Solomadin, M., Turebekov, N., Babayeva, M., Fomin, G., Yadagiri, G., Renu, S., Yerubayev, T., Petrovsky, N., Renukaradhya, G. J., & Tabynov, K. (2023). An intranasal vaccine comprising SARS-CoV-2 spike receptor-binding domain protein entrapped in mannose-conjugated chitosan nanoparticle provides protection in hamsters. Scientific reports, 13(1), 12115.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update