| 최근 플라스틱 생분해 연구 동향 | |
|---|---|
| Date 2024-04-29 18:14:41 |
|

조교수 / 박사과정
경북대학교 식품공학부(과)
dhkim85@knu.ac.kr / lilikkrisnamukti@gmail.com
플라스틱 오염과 그 영향
전 세계적으로 매년 평균 4억 3천만 톤의 플라스틱이 생산된다 [1]. 2023년 유엔이 언급한 바에 따르면, 플라스틱 쓰레기의 46%가 매립되고, 17%는 소각되며, 9%만이 재활용되고 여전히 22%가 부적절하게 관리되어 쓰레기가 되고 있다. 또한, 해양 생태계로 유입되는 쓰레기의 최소 85%가 플라스틱으로 이루어져 있다. 플라스틱 쓰레기의 대량 생산은 생물 다양성, 기후 위기, 인간 건강에 파괴적인 영향을 끼친다. 플라스틱 쓰레기는 환경에 유해 화학물질을 방출하는데 육상 및 해양생물들이 미세플라스틱을 섭취할 위험에 처하게 한다 [2,3]. 또한, 플라스틱을 중합할 때 물성조절을 위하여 다양한 가소제들을 이용하는데, 플라스틱이 물리적으로 깨지면서 이러한 물질들이 환경으로 용출되어 다양한 환경오염을 유발할 수 있다. 그 외에도, 추정에 따르면 2050년까지 플라스틱에서 발생하는 온실가스 배출량은 전체 할당된 탄소의 거의 13%를 차지하며, 이는 기후 위기를 악화시킬 수 있는 원인이 될 수 있다 [4]. 또한, 환경에서 미세플라스틱은 항생제 내성 유전자의 수평 전달(horizontal gene transfer)을 촉진할 수 있다. 그 이유는 플라스틱은 박테리아가 플라스틱에서 자라면서 항생제 내성 유전자(Anibiotic Resistance Genes, ARGs)를 포함한 유전 물질을 교환할 수 있는 생물막 형성을 위한 표면으로 작용할 수 있다. 이와 같은 현상은 항생제 내성의 확산을 증가시켜 박테리아 감염의 치료를 복잡하게 하고 공중 보건에 위협을 가할 수 있다 [5]. 해양환경에서 미세플라스틱은 제안된 바다 표면을 청소하기 위한 부유물, 보트, 필터로는 제거하기가 어렵고, 너무 작아서 잡히지 않으며, 대부분의 비중이 바닷물보다 무거워 해저로 가라앉아 해양환경의 심각한 오염을 초래한다 [6]. 따라서, 해양생태계, 나아가 지구생태계를 플라스틱 오염으로부터 보호하기 위한 예방 조치와 해결책이 절실한 실정이다. 이러한 노력의 일환으로, 우선적으로 플라스틱 사용을 감소하는 것이 있을 수 있는데, 오늘날 우리가 사용하는 많은 부분이 플라스틱으로 이루어져 있어 절대적인 사용감소는 불가능하다. 따라서, 이미 사용되었던 플라스틱을 적절한 방식을 통해 재사용 및 재활용하는 방법을 모색하여야 한다. 다른 방법으로는 환경에서 분해가 잘되는 생분해 플라스틱을 개발하고 이용하는 것이다. 이러한 방안은 앞으로 점차 생분해 플라스틱을 사용하는 방안으로 확대될 것이라고 판단된다. 그러나, 이미 사용된 플라스틱 또는 생분해 플라스틱으로 대체할 수 없는 플라스틱에 대한 효과적인 재활용 방법이 필요할 것이다. 많은 과학자들이 오늘날 효과적인 플라스틱 재활용 방법을 개발하기 위해 많은 노력을 하고 있으며, 대표적으로 물리적, 화학적, 생물학적 재활용 방법이 있을 수 있다. 각각의 장단점이 존재하는데 여기에서는 생물학적 재활용을 위해 선행되어야 하는 플라스틱의 생물학적 분해에 대해서 이야기하고자 한다.
플라스틱 생분해의 도전 과제
다양한 연구에서는 박테리아, 곰팡이, 조류 등의 다양한 미생물이 여러 플라스틱들을 분해한다고 보고 하였다 (표 1). 환경에서 플라스틱 분해에 관여하는 일반적인 미생물 경로는 생물오염(biodeterioration), 탈중합(Depolymerization), 동화(Assimilation), 무기화(Mineralization) 등 여러 주요 단계를 포함한다 (그림 1). 많은 연구에서 다양한 환경의 미생물이 플라스틱을 분해할 수 있는 능력을 보여주었음에도 불구하고, 생분해 과정은 본질적으로 느리며 종종 많은 시간이 소요된다. 그 이유는 플라스틱은 인간의 목적에 맞게 합성된 고분자이기에 복잡한 구조와 화학 결합을 가지고 있어 자연 유래 미생물들은 이를 분해할 수 있는 시스템(효소)이 결여되어 있다. 또한, 플라스틱은 결정성이 높고 수용액 상태로 존재하지 않아 기질에 접근 및 분해하기가 매우 어렵다 [7]. 따라서, 이러한 낮은 생분해능을 개선하기 위해, 많은 연구자들이 다음의 일련의 방법들을 고안하여 분해능을 개선하고자 노력하고 있다.
표 1. Plastic degrading microbes
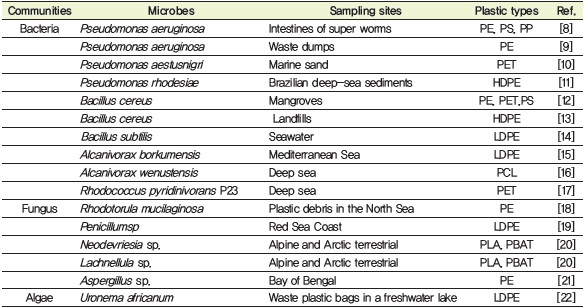
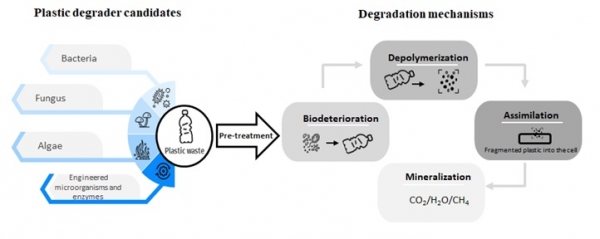
그림 1. 잠재적인 플라스틱 생분해자 및 생분해 원리.
플라스틱 생분해의 기술 발전
플라스틱의 생분해 과정을 개선하기 위해, 연구자들은 사전 처리 방법, 유전자 조작, 효소 공학, 유전 공학 등을 탐구하여 생분해 과정을 향상시키고 플라스틱 폐기물 관리를 위한 더 효율적인 해결책을 개발하고 있다.
• 생분해 전 플라스틱 사전 처리
플라스틱의 사전 처리는 생분해를 가속화하는 중요한 단계로 여겨진다. UV 방사선과 플라즈마 처리와 같은 기술이 플라스틱의 물리적 특성을 변경함으로써 효소 및 미생물 분해를 증진시키는 것으로 보고되고 있다. 이러한 사전 처리는 표면적을 증가시키고, 분자량을 감소시키며, 분해하는 유기체와 효소에게 더 접근하기 쉽게 하는 기능적 그룹을 도입할 수 있다 [23]. 연구자들은 UV 사전 처리가 폴리프로필렌(polypropylene, PP)의 표면 특성을 변경하여 미생물 분해에 대한 취약성을 높임으로써 PP의 생물 분해를 가속화한다는 것을 발견하였다. UV은 PP 표면의 폴리머 체인을 분해하여 자유 라디칼, 이중 결합 및 카보닐(C=O) 또는 하이드록실(-OH) 그룹과 같은 반응성을 나타낼 수 있는 사이트를 형성하였다. 이러한 반응성 사이트는 PP의 표면 에너지와 화학적 반응성을 증가시켜 미생물 공격에 더 취약하게 만든다. 또한, UV 처리는 PP 표면의 친수성을 증가시켜 물 흡수 및 미생물 부착을 향상시키고, 미생물이 PP 표면에 서식할 수 있는 환경을 형성할 수 있게 하였다 [24]. 또 다른 연구에서는 햇빛 사전 처리가 밀랍나방(waxworm)의 미네랄화 된 배설물의 잔류물(excreta residue)을 통해 저밀도 폴리에틸렌(low-density polyethylene, LDPE)의 생분해를 개선한다는 것을 발견하였다. 사전 처리된 LDPE 필름이 직접 햇빛에 노출될 때 대조군에 비해 높은 표면 거칠기를 나타내고, 햇빛 사전 처리가 밀랍나방에 의한 미네랄화를 가속화한다는 것이 FTIR, 1H NMR, GC-MS 방법을 사용한 물리화학적 파라미터의 변화로 입증되었다. 추가적인 카보닐 및 알코올 그룹의 존재와 불포화 탄화수소의 증가는 폴리에틸렌 필름이 분해되고 미네랄화되고 있음을 나타낸다. 간단히 말해서, UV 사전 처리와 밀랍나방 장을 통한 생분해의 상승작용은 처리하지 않은 LDPE보다 사전 처리된 LDPE의 분해를 더 효과적으로 만들었다 [25]. 또 다른 사례에서, LDPE 샘플을 상온 공기에서 비열 플라즈마 처리하고 약 4%의 CO2를 추가함으로써 산화 종(oxidative species)의 증가로 인해 생분해가 증가할 수 있으며, 이는 미생물 부착 및 폴리머 샘플 표면에 대한 수용성을 개선하였다. 연구에서는 또한 소량의 CO2를 추가하는 것이 단순히 상온 공기를 사용하는 것보다 LDPE 샘플의 생분해에 더 유리하다는 것을 발견했으며, 이러한 가스 조성 및 화학 변화로 라만 분광법으로 감지된 탄소 결합이 훨씬 더 감소하였다 [26].
• 유전 공학: PET 분해를 위한 유전자 조작 및 효소 공학
오늘날 많은 연구자들이 기존에 발견되었던 효소를 기반으로 단백질 공학을 통해 효소의 활성 부위를 수정하거나 새로운 결합을 도입함으로써, 성능이 좋은 플라스틱 분해 효소들을 개량하는 연구를 활발히 하고 있다. 이러한 플라스틱 분해 효소 개량 연구는 오늘날 대부분이 폴리에틸렌 테레프탈레이트(polyethylene terephthalate, PET) 분해 효소에 촛점이 맞춰져 있다. 2016년 일본의 연구그룹에서 쓰레기더미 토양에서 Ideonella sakaiensis에서 PET를 분해하는 데 관여하는 효소 두 가지(MHETase 및 PETase)를 밝혀냈고, 이 미생물이 PET 단량체인 테레프탈산을 대사하는 경로를 밝혀냈다 [27]. 이 연구가 발표된 이후로 많은 과학자들이 Is PETase뿐만 아니라, 기존에 보고된 PETase의 활성을 높이기 위해 다양한 단백질 공학기법을 적용하며 기술을 발전시켜왔다. 또한, 플라스틱 분해 효소의 유전자를 오늘날 생명공학연구에 많이 이용되고 있는 미생물에 도입시킴으로써 플라스틱을 분해하는 미생물 분해체를 공학적으로 설계하였다. 예를 들어, Escherichia coli 및 Saccharomyce cerevisiae는 DNA 도입의 용이성, 빠른 성장, 높은 단백질 발현 능력으로 인해 유리한 숙주로 여겨진다. 유전적으로 설계된 S. cerevisiae BY 4741과 E. coli에서 망간 의존성 퍼옥시다제와 같은 효율적인 플라스틱 분해 효소가 생산되었고, 또 다른 효과적인 플라스틱 분해 효소인 laccase는 E. coli BL21과 Phanerochaete chrysosporium 균주를 유전적으로 변형하여 성공적으로 생산되었다 [28]. 그리고 많이 연구되고 있는 PET 분해효소 중 높은 열안정성을 지니고 있다고 보고된 cutinase (leaf-branch compost, LCC)를 Clostridium thermocellum를 이용하여 세포외로 분비되는 능력을 향상시키 위한 호스트로 연구되었다. 이 연구를 통해 LCC의 분비생산을 가능하게 하는 cellulase Cel48S의 signal peptide 서열과 Clo1313_2638 유전자의 구성 프로모터(P2638)의 삽입을 진행하였다. 이 공학적으로 설계된 미생물 촉매는 LCC의 발현을 향상시키고 60℃에서 상업적 PET 필름을 분해하였다. 초기 PET 필름의 약 60%가 14일 배양 후 가용성 단량체로 전환되었다 [29]. 그리고 최근에는 단백질 공학을 통해 개량된 LCC가 최소 10시간 이내에 PET를 단량체로 90% 이상 분해하는 놀라운 결과를 보였으며, 생산성은 시간당 리터당 16.7 g/L/h의 테레프탈레이트산 생산성을 보였다 [30]. 또한, DuraPETase-4M과 같은 다른 사례에서는, 효소의 전체 안정성(N233C/S282C) 개선, 주요 영역의 유연성 조절(H214S), 그리고 단백질 표면 정전기적 전위의 최적화(S245R)를 통해 PET의 열 안정성 및 생분해성을 개선하였다. 이 공학적으로 설계된 효소는 열 안정성 및 생분해성 측면에서 수정되지 않은 DuraPETase를 능가했으며, 무정형 PET 분말과 PET 성형 필름을 각각 3.2배와 5.4배 더 빠른 속도로 분해했다 [31]. 2023년, 연구자들은 상온에서 뛰어난 PET 분해 능력을 가진 Cryptosporangium aurantiacum에서 생산된 PET 분해효소를 보고하였다. CaPETase의 결정 구조 연구는 활성 부위의 구조와 기질 결합 홈(cleft)을 형성하는 잔기에서의 특이성을 밝혀냈으며, 다른 PET 분해효소들과 비교하였다. 단기간에, 수정된 CaPETase, 특히 CaPETase M9 버전은 pH-stat 생물반응기에서 55℃에서 1일 미만으로 PET 샘플을 효과적으로 거의 다 분해했다 [32]. 그 외에도, Aspergillus fumigatiaffinis(AfC)에서 얻은 cutinases의 열 안정성을 향상시켜 60℃에서 PET 가수분해 활성을 4배 증가시켰다. 이 공학적으로 설계된 효소는 사용 후 PET 필름을 12일 내에 완전히 분해하였다. 이 연구는 또한 Humicola insolens cutinase(HiC)와의 구조를 비교하고 고활성 및 열 안정성을 가진 단일 곰팡이 cutinase를 식별하여 매우 활성화되고 안정적인 cutinase 변이체를 생성하였다 [33].
결론 및 전망
플라스틱 오염은 환경과 생명체에 심각하고 파괴적인 영향을 미친다. 이 상황을 극복하는 방법은 효율적으로 플라스틱을 재활용 할 수 있는 시스템을 구축하는 것이다. 플라스틱을 재활용하는 방법 중 생물학적 방법이 환경친화적인 방법으로 여겨진다. 이를 위해 오늘날 플라스틱을 분해할 수 있는 여러 미생물과 효소가 개발되고 있으며, 분해 메커니즘이 밝혀지고 있다. 생물학적 플라스틱 분해에 영향을 미치는 요소들을 이해하고 생분해 활성을 향상시키기 위한 단백질 공학의 발전, 플라스틱 생분해의 정도를 정량화하기 위한 통일된 기준의 설정, 인간과 동물의 몸 내에서 안전하게 플라스틱 폴리머를 분해할 수 있는 후보자를 탐색하여 건강에 미치는 잠재적인 부정적 영향을 최소화하기 위해 지속적으로 연구되어야 한다.
참고문헌
1. United Nations. (2023). Explainer: What is plastic pollution? [United Nations Sustainable Development]. Retrieved from https://www.un.org/sustainabledevelopment/blog/2023/08/explainer-what-is-plastic-pollution/
2. Geneva Environment Network. (2024). Plastics and Biodiversity [Plastics and the Environment Series]. Retrieved from https://www.genevaenvironmentnetwork.org/resources/updates/
3. Nelms, S. E., Barnett, J., Brownlow, A., Davison, N. J., Deaville, R., Galloway, T. S., ... & Godley, B. J. (2019). Microplastics in marine mammals stranded around the British coast: ubiquitous but transitory?. Scientific Reports, 9(1), 1075.
4. Center for International Environmental Law (CIEL). (2022). Plastic & Climate: The Hidden Costs of a Plastic Planet [Project Update]. Retrieved from https://www.ciel.org/plasticandclimate/
5. Huang, W., Song, B., Liang, J., Niu, Q., Zeng, G., Shen, M., ... & Zhang, Y. (2021). Microplastics and associated contaminants in the aquatic environment: A review on their ecotoxicological effects, trophic transfer, and potential impacts to human health. Journal of Hazardous Materials, 405, 124187.
6. Fiore, M., Fraterrigo Garofalo, S., Migliavacca, A., Mansutti, A., Fino, D., & Tommasi, T. (2022). Tackling marine microplastics pollution: an overview of existing solutions. Water, Air, & Soil Pollution, 233(7), 276.
7. Alexander, M. (1975). Environmental and microbiological problems arising from recalcitrant molecules. Microbial ecology, 17-27.
8. Lee, H.M., Kim, H.R., Jeon, E., Yu, H.C., Lee, S., Li, J., & Kim, D. H. (2020) Evaluation of the Biodegradation Efficiency of Four Various Types of Plastics by Pseudomonas aeruginosa Isolated from the Gut Extract of Superworms. Microorganisms,8,1341.
9. Gupta, K.K. & Devi, D. (2020) Characteristics investigation on biofilm formation and biodegradation activities of Pseudomonas aeruginosa strain ISJ14 colonizing low density polyethylene (LDPE) surface. Heliyon, 6, e04398
10. Bollinger, A., Thies, S., Knieps-Grünhagen, E., Ferrer, M., Gohlke, H., Smits, S. H., & Jaeger, K. E. (2020). A novel polyester hydrolase from the marine bacterium Pseudomonas aestusnigri–structural and functional insights. Frontiers in microbiology, 11, 510772.
11. Oliveira, M. M., Proenca, A. M., Moreira-Silva, E., de Castro, A. M., Dos Santos, F. M., Marconatto, L., & Medina-Silva, R. (2021). Biofilms of Pseudomonas and Lysinibacillus marine strains on high-density polyethylene. Microbial ecology, 81, 833-846.
12. Auta, H. S., Emenike, C. U., & Fauziah, S. H. (2017). Screening of Bacillus strains isolated from mangrove ecosystems in Peninsular Malaysia for microplastic degradation. Environmental Pollution, 231, 1552-1559.
13. Kopecká, R., Kubínová, I., Sovová, K., Mravcová, L., Vítěz, T., & Vítězová, M. (2022). Microbial degradation of virgin polyethylene by bacteria isolated from a landfill site. SN Applied Sciences, 4(11), 302.
14. Khandare, S. D., Agrawal, D., Mehru, N., & Chaudhary, D. R. (2022). Marine bacterial based enzymatic degradation of low-density polyethylene (LDPE) plastic. Journal of Environmental Chemical Engineering, 10(3), 107437.
15. Delacuvellerie, A., Cyriaque, V., Gobert, S., Benali, S., & Wattiez, R. (2019). The plastisphere in marine ecosystem hosts potential specific microbial degraders including Alcanivorax borkumensis as a key player for the low-density polyethylene degradation. Journal of hazardous materials, 380, 120899.
16. Sekiguchi, T., Saika, A., Nomura, K., Watanabe, T., Watanabe, T., Fujimoto, Y., ... & Kanehiro, H. (2011). Biodegradation of aliphatic polyesters soaked in deep seawaters and isolation of poly (ɛ-caprolactone)-degrading bacteria. Polymer Degradation and Stability, 96(7), 1397-1403.
17. Guo, W., Duan, J., Shi, Z., Yu, X., & Shao, Z. (2023). Biodegradation of PET by the membrane-anchored PET esterase from the marine bacterium Rhodococcus pyridinivorans P23. Communications Biology, 6(1), 1090.
18. Vaksmaa, A., Polerecky, L., Dombrowski, N., Kienhuis, M. V., Posthuma, I., Gerritse, J., ... & Niemann, H. (2023). Polyethylene degradation and assimilation by the marine yeast Rhodotorula mucilaginosa. ISME communications, 3(1), 68.
19. Ameen, F., Moslem, M., Hadi, S., & Al-Sabri, A. E. (2015). Biodegradation of Low-Density Polyethylene (LDPE) by Mangrove fungi from the red sea coast. Progress in Rubber Plastics and Recycling Technology, 31(2), 125-143.
20. Rüthi, J., Cerri, M., Brunner, I., Stierli, B., Sander, M., & Frey, B. (2023). Discovery of plastic-degrading microbial strains isolated from the alpine and Arctic terrestrial plastisphere. Frontiers in Microbiology, 14, 1178474.
21. Sarkhel, R., Sengupta, S., Das, P., & Bhowal, A. (2020). Comparative biodegradation study of polymer from plastic bottle waste using novel isolated bacteria and fungi from marine source. Journal of Polymer Research, 27, 1-8.
22. Sanniyasi, E., Gopal, R. K., Gunasekar, D. K., & Raj, P. P. (2021). Biodegradation of low-density polyethylene (LDPE) sheet by microalga, Uronema africanum Borge. Scientific Reports, 11(1), 17233.
23. Yasin, N. M., Akkermans, S., & Van Impe, J. F. (2022). Enhancing the biodegradation of (bio) plastic through pretreatments: A critical review. Waste Management, 150, 1-12.
24. Samat, A. F., Carter, D., & Abbas, A. (2023). Biodeterioration of pre-treated polypropylene by Aspergillus terreus and Engyodontium album. npj Materials Degradation, 7(1), 28.
25. Kundungal, H., Gangarapu, M., Sarangapani, S., Patchaiyappan, A., & Devipriya, S. P. (2021). Role of pretreatment and evidence for the enhanced biodegradation and mineralization of low-density polyethylene films by greater waxworm. Environmental technology, 42(5), 717-730.
26. Scally, L., Gulan, M., Weigang, L., Cullen, P. J., & Milosavljevic, V. (2018). Significance of a non-thermal plasma treatment on LDPE biodegradation with Pseudomonas Aeruginosa. Materials, 11(10), 1925.
27. Yoshida, S., Hiraga, K., Takehana, T., Taniguchi, I., Yamaji, H., Maeda, Y., Toyohara K., Kimura Y., & Oda, K. (2016). A bacterium that degrades and assimilates poly (ethylene terephthalate). Science, 351(6278), 1196-1199.
28. Jaiswal, S., Sharma, B., & Shukla, P. (2020). Integrated approaches in microbial degradation of plastics. Environmental Technology & Innovation, 17, 100567.
29. Yan, F., Wei, R., Cui, Q., Bornscheuer, U. T., & Liu, Y. J. (2021). Thermophilic whole-cell degradation of polyethylene terephthalate using engineered Clostridium thermocellum. Microbial biotechnology, 14(2), 374-385.
30. Tournier, V., Topham, C. M., Gilles, A., David, B., Folgoas, C., Moya-Leclair, E., ... & Marty, A. (2020). An engineered PET depolymerase to break down and recycle plastic bottles. Nature, 580(7802), 216-219.
31. Liu, Y., Liu, Z., Guo, Z., Yan, T., Jin, C., & Wu, J. (2022). Enhancement of the degradation capacity of IsPETase for PET plastic degradation by protein engineering. Science of The Total Environment, 834, 154947.
32. Hong, H., Ki, D., Seo, H., Park, J., Jang, J., & Kim, K. J. (2023). Discovery and rational engineering of PET hydrolase with both mesophilic and thermophilic PET hydrolase properties. Nature communications, 14(1), 4556.
33. Lee, S. H., Kim, M., Seo, H., Hong, H., Park, J., Ki, D., & Kim, K. J. (2024). Characterization and Engineering of a Fungal Poly (ethylene terephthalate) Hydrolyzing Enzyme from Aspergillus fumigatiaffinis. ACS Catalysis, 14, 4108-4116.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
