| 오가노이드 기반 조직재생 치료제: 줄기세포와 조직공학 기술의 융합 | |
|---|---|
| Date 2024-04-29 17:12:19 |
|

교수 / 박사과정
세대학교 생명공학과
seungwoocho@yonsei.ac.kr / pjmarch@yonsei.ac.kr
1. 서론
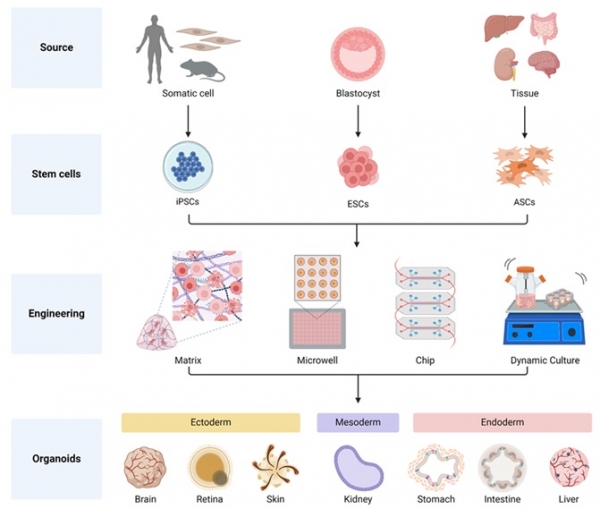
오가노이드(organoid)는 줄기세포로부터 증식 및 분화 과정을 거쳐 형성된 3D 구조체를 의미하며, 실제 장기의 중요한 기능들과 구조적 복잡성을 모사할 수 있는 특징을 가지고 있어서 ‘장기 유사체’ 혹은 ‘미니 장기’라고도 불린다 [1]. 오가노이드는 체내에 존재하는 조직 유래 성체줄기세포(adult stem cells; ASCs)를 활용할 수도 있고 체세포를 역분화시켜 제작한 유도만능줄기세포(induced pluripotent stem cells; iPSCs) 또는 배아줄기세포(embryonic stem cells; ESCs) 같은 만능성 줄기세포(pluripotent stem cells; PSCs)를 활용하여 제작할 수 있다. 줄기세포를 이용하여 제작한 오가노이드는 실제 장기의 복잡한 구조와 기능을 모사할 수 있다는 특징을 가지기 때문에, 지금까지 2D 세포 배양 기술로는 구현하기 어려웠던 정밀한 질병 모델의 제작을 가능하게 한다. 다양한 공학 기술을 접목하여 제작한 고도화된 오가노이드는 질병 모델링과 약물 개발에 활용되고 있으며 궁극적으로는 오가노이드와 조직공학 기술이 접목되어 실제 장기 및 조직을 치료하는 조직재생 치료제로서 활용될 전망이다 [2].
이렇듯 오가노이드가 가지는 장점과 활용 가능 분야가 다양하지만, 단순히 몇 종류의 세포만으로 구성되어 3D 구조를 이루는 현재 오가노이드 기술의 한계를 뛰어넘어 다양한 조직 특이적인 세포 및 미세환경 구현을 통한 고도화 과정을 거쳐야만 더욱 실제 장기와 유사도를 높일 수 있다 [3]. 오가노이드를 고도화시키는 다양한 방식 중에서 이번 원고에서는 보다 공학적인 방식에 초점을 맞춰 설명하고자 한다. 첫 번째로 줄기세포의 분화 과정을 발생학적 관점에 맞춰 개선함으로써 실제 장기를 구성하는 다양한 세포들로 오가노이드를 구성할 수 있게 하는 방식이 존재하고, 두 번째로 탈세포 매트릭스(decellularized extracellular matrix; dECM)와 같은 장기 특이적 오가노이드 배양 소재를 접목시켜 오가노이드 주변의 미세환경을 고도화시키는 방식이 존재한다. 또한, 세포 칩(chip) 배양 방식과 미세유체배양(microfluidic culture) 혹은 역동적 배양(dynamic culture) 등의 배양 방식을 활용하여 오가노이드 주변 환경의 물리적인 특성에 변형을 주는 방식 또한 가능하다 [4].
최근 다양한 고도화 방식을 통하여 고기능성 오가노이드가 제작 가능해짐과 동시에 세포치료제가 주목받으면서 오가노이드를 활용한 조직재생 치료에 대한 관심도 커지고 있다. 오가노이드를 조직재생 치료제로 사용하기 위해 체외에서 배양한 오가노이드를 체내에 이식하려면 세포에 대한 높은 이해도뿐만 아니라 조직공학에 대한 높은 이해도가 요구되는데, 이번 오가노이드 기획 특집에서는 이러한 조직공학을 접목한 오가노이드 기반의 조직재생 치료제 연구를 소개해 보고자 한다 [5].
그림 1. 오가노이드 제작에 활용되는 다양한 종류의 줄기세포 및 고도화 방식.
2. 오가노이드의 고도화를 통한 조직재생 치료제의 확립
앞서 언급했듯이 오가노이드가 다양한 활용성을 가지고 있지만, 이를 생체 내 환경에 적용하려면 기존 체외배양 환경보다 더 고도화된 특성을 가져야 한다. 조직재생 치료제를 위한 오가노이드 고도화 전략은 크게 세 가지 방식으로 접근하며 1) 줄기세포의 분화 프로토콜 개선을 통한 오가노이드 구성 세포의 다양화 및 성숙화 2) 생체소재 접목을 통한 생체 내 환경 모사 3) 미세유체 칩 시스템을 활용한 조직 모사 및 역동적 배양 방식이 존재한다.
2.1. 분화 프로토콜 개선을 통한 구성 세포의 다양화 및 성숙화
기존 2D 세포 모델과 비교하였을 때 오가노이드가 가지는 큰 장점 중 하나는 다양한 세포가 유기적으로 3D 구조체 내에 함께 존재하며 기능을 한다는 것이다. 그러므로 줄기세포 분화를 통해 오가노이드를 형성할 때는 다양한 기능성 세포로 분화가 잘 유도되어야만 한다. 하지만 하나의 장기를 구성하는 다양한 종류의 세포들은 각자 고유의 발생 단계들을 거쳐 형성되기 때문에 그 유래가 되는 배엽이 다른 경우가 많다. 그렇기 때문에 오가노이드 연구 초기 단계에서 다양한 배엽 유래의 세포를 줄기세포로부터 한 번에 분화시키는 것은 매우 어려운 과제였다. 이에 대한 해결책으로 연구자들은 줄기세포를 이용하여 장기를 구성하는 서로 다른 세포를 따로 분화시킨 후 응집해 3D 구조체를 형성하여 오가노이드를 제작하는 방식을 주로 사용했다. 그러나 줄기세포 및 발생학적 사고에 대한 이해도가 높아지고 조직을 구성하는 세포들에 대한 분화 방식들이 확립된 이후에는 만능성 줄기세포로부터 장기를 구성하는 다양한 세포로 동시에 분화하는 방식이 보고되었다 [6].
간의 경우를 예시로 들어보면, 간은 크게 간 세포(hepatocyte), 간 성상세포(hepatic stellate cell), 쿠퍼 세포(kupffer cell) 그리고 간 굴모양 혈관 내피세포(liver sinusoidal endothelial cells)등으로 구성되어 있는데, 간 오가노이드 연구 초기에는 다양한 종류의 세포를 동시에 분화 유도하는 방법이 연구되지 않았기 때문에 세포들의 분화를 각각 유도 후 사용하거나 세포주를 사용하여 응집시킨 형태의 liver bud 오가노이드를 제작하였다 [7-9]. 그러나 이러한 방식으로 간 오가노이드를 제작하려면 동시에 3~5가지 정도의 세포를 많은 양 배양해야 한다는 번거로움이 존재하며, 이렇게 형성한 liver bud는 오가노이드의 중요한 특징인 세포들의 자가 구조화를 통한 장기 특이적 구조 모사가 불가능하다는 한계점이 존재한다. 이러한 한계점을 극복하고자, 2019년 Takanori Takebe 교수 연구팀이 새로운 유도만능줄기세포 유래 간 오가노이드 형성 방식을 활용한 연구결과를 발표하였으며, 이 방식은 실제 인간의 간 발생 과정과 유사하게 진행된다는 특징을 가진다 [10]. 해당 형성 방식에서는 미분화 상태의 만능성 줄기세포를 완전 내배엽(definitive endoderm)으로 약 3일 동안 분화 유도시킨 이후에 전장 내배엽(foregut endoderm) 세포로 약 3일 간 추가 분화 유도를 진행하면 간 오가노이드를 형성할 수 있는 전구세포를 얻을 수 있다 [11]. 이후 이 세포들을 세포외기질(extracellular matrix; ECM)에 넣어 약 2주 정도 배양하게 되면 간 조직을 구성하는 다양한 종류의 세포들로 분화가 유도되어, 최종적으로 형성된 간 오가노이드 내에 적정 비율로 간을 구성하는 다양한 세포가 존재하게 된다. 이렇게 전장 내배엽세포와 같은 한 가지의 전구세포를 분화시켜 오가노이드를 형성하는 프로토콜이 가지는 장점은 1) 전구세포의 동결보존을 통해 대량 보관 및 즉시 사용이 가능하고 2) 초기 단계에 한 가지 세포의 분화 유도만 요구되기 때문에 분화에 사용되는 비용이 상대적으로 적으며 3) 전구세포로부터 간을 구성하는 세포로의 분화 유도를 동시에 진행하여 형성된 오가노이드이기 때문에 구성하는 세포의 종류가 다양하게 존재한다는 점이다. Takebe 교수 연구팀은 새롭게 개발한 간 오가노이드 모델을 이용하여 비알코올성 지방 간염(non-alcoholic steatohepatitis; NASH) 오가노이드 모델을 확립하였고 관련된 발병 기전 연구와 약물 개발에 활용하는 다양한 연구를 진행 중이다 [10,12,13].
2.2. 생체소재 접목을 통한 생체 내 환경 모사
앞서 언급한 대로, 오가노이드를 배양할 때는 적합한 세포외기질 성분이 요구되며, 현재 대부분의 연구자들은 ‘Matrigel’ 이라는 제품을 대중적으로 사용 중이다. 이 제품은 쥐의 육종암(sarcoma) 조직으로부터 유래했으며, 구성 성분의 대부분이 라미닌(laminin)으로 구성되어 있다는 특징을 가진다 [14]. 다른 종의 암 조직에서 유래한 재료이기 때문에 인간의 세포 배양 시에 문제가 발생할 수 있으며, 임상 연구에 적용이 부적절하다는 한계점을 가진다. 우리 몸에 존재하는 다양한 장기 및 조직들은 그를 구성하는 기질 성분들이 매우 다양하며 대부분 조직 특이적인 특성을 지니고 있기 때문에 라미닌 기반의 Matrigel은 오가노이드에 장기 특이적인 특성을 부여하기에 부족함을 가진다. 이러한 한계점을 극복하고자 연구자들은 오가노이드 배양 시에 좀 더 조직 특이적인 배양 환경을 제공하기 위하여 돼지나 인간의 조직으로부터 세포만을 제거하여 세포외기질 성분만 남긴 ‘탈세포 매트릭스’ 라는 것을 개발하였고, 이를 활용한 다양한 오가노이드 배양 연구를 진행하였다 [15-17]. 탈세포 매트릭스는 탈세포 공정 이후 동결 건조 및 분쇄 과정을 거친 후 하이드로젤(hydrogel) 형태로 사용하기 때문에 다양한 농도와 제형을 변형시켜 가며 사용이 가능하다는 장점이 있다. 아직까지 발표된 연구 결과들은 대다수가 인간과 유사한 돼지의 장기를 바탕으로 진행되고 있기는 하지만 대부분의 장기에 대하여 탈세포 매트릭스 연구가 발표된 바 있다. 이번 원고에서는 그 중에서도 위와 장에 관한 연구를 간단하게 소개하고자 한다.
기존의 많은 연구자들이 사용하는 쥐의 성체줄기세포 유래 위, 장 오가노이드 형성 방식은 각각 ‘gastric gland’와 ‘intestinal crypt’라는 성체줄기세포를 포함하는 세포 덩어리를 Matrigel 같은 매트릭스 내에 넣어 배양을 진행하고 다양한 세포들로 증식 및 분화를 진행하는 방식이다 [18,19]. 성체줄기세포 유래의 오가노이드를 형성할 때는 줄기세포 주변의 미세환경이 중요하게 작용하는데 라미닌 기반의 Matrigel은 실제 장기 특이적 세포외기질 성분들과 유사도가 떨어진다. 반면에 탈세포 매트릭스는 조직 특이적인 콜라겐(collagen)과 세포외기질 단백질들로 구성되어 있어서 실제 생체 내에서의 환경을 보다 정확하게 모사할 수 있다 [16]. 본 저자의 연구팀에서 보고한 바에 따르면 위 오가노이드를 Matrigel 대신 위 탈세포 매트릭스(stomach extracellular matrix; SEM)를 이용하여 배양할 경우, 위에 존재하는 주세포(chief cell)의 지표인 Pgc와 벽세포(parietal cell)의 지표인 Atp4a와 Atp4b의 유전자 발현이 Matrigel에서 배양한 그룹 대비 2배에서 최대 5배까지 증가하는 것을 확인할 수 있었고, 장 오가노이드의 경우에는 장 탈세포 매트릭스(intestinal extracellular matrix; IEM)를 이용해 배양하였을 때 장 줄기세포 유전자인 Lgr5와 배상세포(goblet cell)의 지표인 Muc2의 발현이 약 2배 이상씩 증가하였다. 또한 이러한 효과가 장기 특이적 탈세포 매트릭스로 인한 효과인 것을 확인하기 위해 각각의 위, 장 오가노이드를 피부 탈세포 매트릭스(skin extracellular matrix; SkEM)에서 배양했을 때, 위와 장 모두에서 중요 유전자들의 발현이 위, 장 유래 탈세포 매트릭스에서 배양했을 때보다 대폭 감소하는 것을 알 수 있었다 [16]. 이를 통해 조직유래 탈세포 매트릭스가 실제로 장기 특이적인 환경을 제공하는 효과가 있음을 확인하였으며 더 나아가서 Matrigel과 같은 쥐 육종암 유래의 기질 성분을 대체할 수 있음을 보여주었다. 탈세포 매트릭스의 이러한 장점을 활용하여 부착형 패치나 지지체 혹은 접착제와 같은 용도로 오가노이드와 함께 이식된다면 이식 주변 부위와 자연스럽게 융화되어 오가노이드의 생착을 돕고 주변 조직의 재생을 향상시킬 수 있는 조직공학 재료로 활용될 수 있을 것이다.

그림 3. 탈세포 매트릭스를 활용한 위, 장 오가노이드 연구(참고문헌 [16] 인용). (a) 탈세포 매트릭스를 이용한 위, 장 오가노이드 배양 모식도. (b) 위, 장 탈세포 매트릭스와 Matrigel의 구성 성분 비교 결과. (c) 탈세포 매트릭스의 장기 특이적 특성 강화 효과 확인 결과. (d) 탈세포 매트릭스를 활용한 오가노이드 이식 후 생착 확인 결과.
2.3. 미세유체 칩 시스템을 활용한 조직 모사 및 역동적 배양
오가노이드를 조직재생 치료제나 약물 개발의 핵심 재료로 사용하기 위해서는 그 물리적 특성과 기능적 특성이 일정해야 한다. 그렇기 때문에 많은 연구자들이 일정한 품질의 기능성 오가노이드 형성 방식을 확립하기 위하여 다양한 공학적 배양 방식을 도입하여 오가노이드의 고도화를 진행하였는데, 가장 대표적인 공학적 배양 방식으로는 오가노이드 온 어 칩(organoid-on-a-chip) 기술과 역동적 배양 등의 방식이 존재한다 [4]. 2020년 Matthias P. Lutolf 교수가 발표한 논문에서는 하이드로젤을 기반으로 동시에 8개의 장 미세구조를 모사할 수 있는 칩을 이용하여 장 오가노이드를 형성시킬 경우, 기존 제작 방식보다 장의 구조적 특징을 더 잘 모사하는 장 오가노이드를 한 번에 대량으로 형성할 수 있음을 발표하였다. 해당 연구에서는 장의 미세구조를 모사하는 채널을 포함한 하이드로젤 기반 3D 미세장치를 제작한 후, 쥐의 장 내에 존재하는 intestinal crypt를 분리하여 채널 내에서 배양하는 방식을 이용해 장 오가노이드를 형성하였다. 그 결과 칩 내에서 장의 crypt-villus 구조와 유사한 모양을 가지는 오가노이드가 다수 형성되었으며 배양 기간이 길어질수록 그 구조적 복잡성이 증가함을 보여주었다. 또한, 장 줄기세포 특이적으로 발현하는 마커인 Lgr5와 장의 대표적인 기능성 지표 마커인 Sox9, Lysozyme, Muc2 등의 발현이 증가하는 것을 확인하였다 [20].
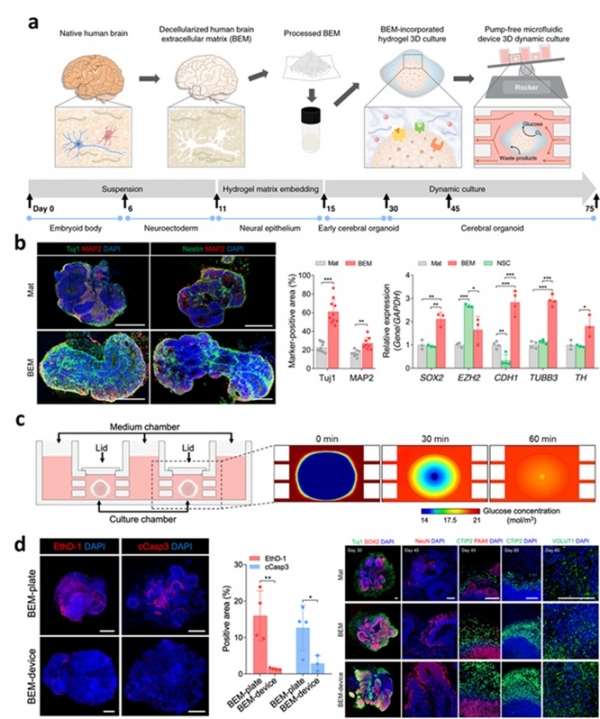
앞서 설명한 배양 방식은 정적인 배양 환경을 가지고 있는 경우가 많은데, 실제 몸속에서는 혈액과 같은 유체의 흐름이 장기에 작용하기 때문에 정적인 배양 환경 보다는 동적인 배양 환경이 실제 체내 환경과 유사하다고 할 수 있다. 다음으로 소개할 공학적 배양 방식은 역동적 배양 방식이며, 주로 유체의 흐름을 세포에 제공하여 역동적인 영양공급을 통해 오가노이드의 구조적인 특징을 강화하거나 성숙화를 통한 기능적 고도화를 유도할 수 있는 방식이다. 역동적 배양 방식을 이용하면 오가노이드 내부로 영양 및 산소의 공급을 더 원활하게 해줄 수 있어서 다른 장기 오가노이드 대비 크기가 큰 뇌 오가노이드 관련 연구에서 빈번하게 이용된다 [21-23]. 본 저자의 연구팀에서 2021년에 발표한 논문에 따르면 인간 유도만능 줄기세포 유래의 뇌 오가노이드를 미세유체 칩 기반 역동적 배양 방식을 통해 배양하였을 경우, 기존 정적인 상태로 배양을 한 오가노이드 보다 그 크기가 증가하며, 원활한 산소 공급이 가능해져서 오가노이드 중심부 세포의 사멸이 감소한 것을 밝혔다. 여기에 더해, 뇌 조직 유래 탈세포 매트릭스(brain extracellular matrix; BEM)까지 접목시켜 뇌 오가노이드의 역동적 배양을 진행하면 역동적 배양만 한 경우보다 더 복잡한 뇌의 구조적 특징을 나타냈으며, 신경줄기세포(neural stem cell) 및 뉴런을 나타내는 유전자 및 단백질의 발현량이 증가하였다 [23]. 해당 결과들을 통하여 역동적 배양 방식이 산소 및 영양물질 공급을 원활하게 하여 오가노이드의 구조적, 기능적 특성을 강화할 수 있음을 알 수 있었으며 추후 조직재생 치료를 위한 오가노이드 고도화 연구에 활용해 볼 수 있을 것이다.
그림 4. 뇌 오가노이드에 탈세포 매트릭스와 역동적 배양 기술을 접목한 연구 결과(참고문헌 [23] 인용). (a) 뇌 오가노이드에 탈세포 매트릭스와 역동적 배양 기술을 접목한 실험 모식도. (b) 뇌 탈세포 매트릭스의 뇌 오가노이드 성숙도 강화 효과. (c) 역동적 배양을 통한 glucose의 흐름 변화 시뮬레이션 모식도. (d) 역동적 배양 기술을 통한 뇌 오가노이드의 중심부 세포사멸 감소 결과 및 신경분화 촉진 결과.
3. 동물실험을 통한 오가노이드 기반 조직재생 치료제의 가능성 확인 연구
앞서 설명했던 다양한 공학 기술을 접목하여 고도화시킨 오가노이드는 질병 모델링을 통한 약물 스크리닝 혹은 조직재생 치료제로서 다양한 분야에 활용할 수 있는데, 앞으로의 내용은 오가노이드와 조직재생공학 기술을 융합하여 조직재생 치료제로서 활용한 연구 사례들에 대하여 좀 더 집중적으로 다뤄보고자 한다.
3.1. 장 오가노이드 이식을 통한 쥐의 장 손상 회복 연구
오가노이드 연구의 시작이 장 오가노이드인 만큼 여러 장기 중에서도 장 오가노이드 연구가 가장 많이 진행되었으며, 임상에 대한 준비도 많이 되어있다. ‘장’이라는 장기는 그 위치와 기능적 특성상 많은 양의 유체가 흐르기 때문에 세포나 오가노이드를 이식할 때 이식한 세포가 이식부위에 얼마나 오랫동안 머무르면서 기능을 발휘하는지가 치료 효과에 큰 영향을 미치는 경우가 많다. 그렇기 때문에 대부분의 연구자들은 장 오가노이드 이식 시 Matrigel을 섞어서 이식하는 방식으로 생착 효과를 증가시켜 연구를 진행하고 있지만 동물실험을 넘어 사람에게 적용하기 위해서는 더 안전하고 생체 적합성이 높은 소재로 대체하여 적용하는 연구가 필요했다 [24]. 이와 관련하여 앞에서 설명했던 쥐의 장 오가노이드와 탈세포 매트릭스 기술을 융합하는 연구 결과에 관해 설명해 보고자 한다. 해당 연구에서는 기존에 널리 사용되는 Matrigel 대신 장 조직 유래 탈세포 매트릭스를 이용하여 오가노이드를 배양하였으며 탈세포 매트릭스를 이용하여 제작한 장 오가노이드가 Matrigel로 제작한 오가노이드 대비 더 뛰어난 성숙도를 보였다. 더 나아가서 쥐의 손상된 장에 오가노이드 이식 실험을 진행할 때, 오가노이드의 생착을 돕기 위해 기존에 사용하던 Matrigel 대신 탈세포 매트릭스를 이용하여 이식을 진행하였다. 그 결과 Matrigel을 이용한 오가노이드 이식 방식에 비해 탈세포 매트릭스를 이용했을 때 더 많은 양의 오가노이드가 더 오래 생착할 수 있음을 확인하였고 오가노이드 내부로의 혈관화가 증가했으며 상처 회복에 관련된 유전자들의 발현량이 증가하는 것을 확인할 수 있었다 [16,17]. 결론적으로 오가노이드 기술에 탈세포 매트릭스 기술을 접목함으로써 ‘오가노이드 이식’이라는 치료 방식의 가능성을 보여주었고, 추후 인간에게 오가노이드를 이식하기 위한 중개연구에 대한 기초를 마련할 수 있었다.
3.2. 간 오가노이드 이식을 통한 쥐의 간 손상 회복 연구
‘간’은 심장을 제외하면 혈관이 많이 분포하는 장기에 속하기 때문에 오가노이드를 이식할 때 이식한 오가노이드의 혈관화가 이식 효과에 큰 영향을 미친다 [7,8]. 또한, 오가노이드 이식을 통해 간의 해독 기능과 알부민(albumin) 분비 등의 기능을 회복하려면 매우 많은 양의 세포가 이식되어야 하는데 이에 대하여 2017년에 Hideki Taniguchi 교수와 Takanori Takebe 교수 연구팀은 인간 유도만능줄기세포 유래의 간 오가노이드를 대량으로 제작하는 연구 내용을 발표하였고 이를 활용하여 급성 간 손상이 유발된 쥐에게 오가노이드를 이식하여 간 기능성을 개선하고 생존 기간을 연장하였다는 연구 결과를 발표한 바 있다 [9]. 해당 연구에서는 인간 유도만능줄기세포를 전장 내배엽세포(foregut endodermal cell)로 2D 환경에서 분화시킨 이후 혈관 내피세포와 중간엽줄기세포(mesenchymal stem cell)를 혼합하여 자가구조화 간 오가노이드(self-organized liver organoid)를 제작하였으며 microwell 시스템을 도입하여 간 오가노이드의 대량생산을 가능하게 하였다. 제작한 간 오가노이드는 체외배양 환경에서 분석했을 때, 알부민과 시토크롬(cytochrome)과 관련된 유전자의 발현이 전장 내배엽세포나 간세포 구체(hepatocyte spheroid)에 비하여 크게 증가하는 것을 확인하였으며 간의 중요한 기능인 암모니아 제거 또한 가능함을 보여주었다. 더 나아가서 제작한 간 오가노이드를 급성 간 손상(acute liver failure)이 유발된 쥐에 이식하였을 경우, 이식한 인간 간 오가노이드에 쥐의 혈관이 잘 융합되었으며 결과적으로 쥐의 생존율이 40% 이상 증가했다 [9]. 더불어 기존 발표한 다른 연구 결과에서는 인간 간 오가노이드 제작을 GMP 환경에서 대량으로 제작할 수 있음을 보여준 바 있다 [9]. 이후 Hideki Taniguchi 교수 연구팀은 앞서 쥐를 통하여 확인한 이식결과를 바탕으로 2020년 돼지에 인간 유도만능줄기세포 유래 간 오가노이드를 이식하여 안전성을 확인한 바 있으며 이를 통하여 추후 조직재생 치료제로서 오가노이드를 활용하는 것에 대한 가능성을 다시 한번 보여주었다 [24,25].
3.3. 망막 오가노이드 이식을 통한 쥐의 시력 손상 회복 연구
망막은 다른 장기에 비해 이식 연구가 쉬운 장기 중 하나인데, 후술하는 몇 가지 특징들이 존재하기 때문이다. 우선, 망막을 포함하는 눈은 외부로 돌출되어 있기 때문에 외과적인 수술에 대한 접근이 다른 장기보다 쉬우며, 눈은 면역 특권(immune privilege)을 가지고 있어 세포 이식 후 면역반응에 의해 치료 효과가 저해될 확률이 비교적 낮다 [26,27]. 또한, 눈에는 굉장히 많은 수의 미세 혈관이 존재하기 때문에 세포 및 오가노이드 이식 후에 혈관화가 잘 진행된다면 산소와 영양공급이 원활하게 이루어져 오가노이드의 생착률이 올라갈 수 있다. 망막의 이러한 이점을 활용하여 2018년 Michiko Mandai 교수 연구팀은 인간 유도만능줄기세포 유래 인공 망막 조직 유사체를 제작하여 쥐의 망막 아래에 이식한 후 약 5~10개월 동안 후속 관찰한 연구 결과를 발표하였다 [28]. 연구진은 질병 모델로 Fonx1 유전자 돌연변이에 의해 로돕신(rhodopsin)에 이상이 생긴 쥐를 사용했으며, 해당 쥐의 망막 아래에 인간 유도만능줄기세포 유래 망막 오가노이드를 이식하고 8개월 후 분석을 진행하였다. 그 결과, 이식한 인간 망막 오가노이드로부터 모든 종류의 인간 광 수용체(photoreceptor)가 생성된 것을 확인하였으며 생성된 광 수용체가 쥐의 쌍극세포(bipolar cell)와 인접한 위치에 존재하는 것을 확인했다. 더 나아가서, 쥐에게 빛 자극을 주었을 경우 이식된 세포들이 빛에 반응하여 전기생리학적 신호에 변화가 생기는 것을 감지할 수 있었다. Michiko Mandai 교수 연구팀은 추후 진행하게 될 인간 대상 임상시험에 대비하기 위하여 두 마리의 원숭이를 이용해 임상시험에서 진행하게 될 분석에 대해서도 준비했다. 광응고법(photocoagulation)으로 원숭이의 망막에 손상을 입히고 2개월이 지난 시점에 인간 유도만능줄기세포 유래 망막 오가노이드를 이식했으며, 광간섭단층촬영(optical coherence tomography)을 통하여 이식 6개월 후에 이식 부위에 로제트(rosette) 구조가 존재함을 확인하였다 [29]. 추가적으로, 인간 세포 특이적 단백질 마커인 STEM121을 이용하여 확인해 본 결과, 원숭이의 손상된 망막 내에서 리커버린(recoverin)을 발현하는 광수용체 세포가 인간 세포에서 유래한 것을 확인할 수 있었다. 다채널 전극(multielectrode array; MEA) 분석을 통한 시야 검증에서도 이식 효과를 확인했는데, 망막 오가노이드를 이식한 원숭이 그룹에서 빛 자극을 주었을 때 더 넓은 범위의 시야를 가지고 있음을 알 수 있었다 [29]. 결론적으로 해당 연구진은 인간 유도만능줄기세포 유래 망막 오가노이드를 동물에 이식했을 때 오가노이드가 개체의 조직과 잘 융합하여 빛에 반응할 수 있는 성숙한 조직으로 발달하고 원숭이와 같은 영장류에서도 면역 거부반응 없이 이식 후 2년 동안 안전하게 시력 회복에 도움을 줄 수 있음을 밝혔다. 해당 연구는 영장류를 대상으로 한 이식을 통해 장기적인 안전성을 확인한 바 있기 때문에 추후 진행하게 될 인간 대상 임상 시험에 대한 좋은 선행 연구가 될 것으로 생각한다.
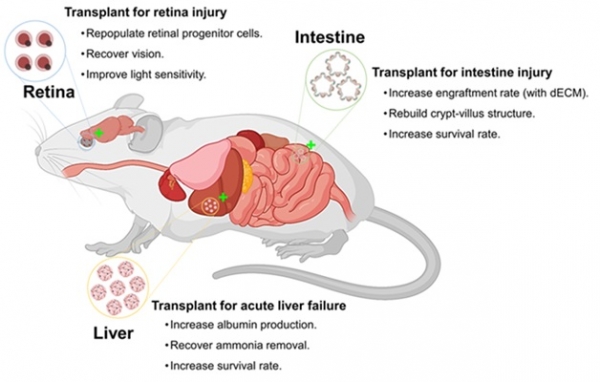
그림 5. 오가노이드 이식을 통한 쥐에서의 조직재생 치료효과 확인.
4. 인간 오가노이드 이식을 통한 인간 조직재생 치료에 대한 안전성 확인 연구
전 세계 수많은 연구진의 노력 덕분에 다양한 장기의 오가노이드 모델에 대한 고도화가 상당 부분 진행되었다 [30]. 그 결과 성공적인 전임상 시험 결과를 확인할 수 있었으며 최종적으로 인간을 대상으로 하는 조직재생 치료를 위한 오가노이드 이식 시험을 진행할 수 있었다 [31-33]. 일본의 Yasuo Kurimoto 교수 연구팀은 앞서 설명했던 인간 유도만능 줄기세포 유래 망막 오가노이드에 대하여 2010년대 후반의 전임상 시험에 대한 성공적인 연구 결과를 바탕으로 2021년 두 명의 망막색소변성증(retinitis pigmentosa) 환자에게 이식하는 임상 시험을 세계 최초로 진행하였고, 약 2년 동안 후속 관찰을 진행한 결과에 대하여 2023년 12월 ‘cell stem cell’에 발표하였다 [34]. 해당 연구팀은 임상 적용이 가능한 동종의 유도만능줄기세포주를 이용하여 망막 오가노이드를 제작한 이후 망막 오가노이드를 세 부분으로 절단하여 가장 바깥쪽 부분을 이식에 사용하고 중간 부분을 유전자 발현 분석을 통한 품질 검증에 사용하였다 [35]. 세 개의 망막 오가노이드 시트를 각각 67세 여성 환자와 42세 남성 환자의 망막 아래에 이식하였으며, 이식 수술 2년 후까지도 이식으로 인한 염증반응 및 종양 형성과 관련된 문제는 발견되지 않았다. 비록 이식 후 초반부에 이식 부위의 두께가 증가하는 현상이 관찰되었지만, 이식 후 2년이 되는 기간 동안 일정 수준 이상으로 과하게 증가하는 양상은 확인되지 않았으며 환자의 망막과 이식한 망막 오가노이드 조직이 잘 융합되어 혈관이 연결되었고 시냅스가 서로 연결되는 것을 확인할 수 있었다. 하지만 망막 오가노이드를 성공적으로 이식하였음에도 불구하고 시력 개선 효과와 관련해 다양한 분석을 진행한 결과, 망막 오가노이드를 이식했음에도 실질적인 시력의 향상으로 이어지지는 않았으며 시각장애가 심했던 환자군에서 시각의 민감도가 증가하는 정도의 효과만을 확인할 수 있었다. 연구진들은 해당 임상 연구 결과에 대하여 동종 세포 유래의 오가노이드를 이식하여 염증반응과 종양형성에 대한 문제없이 2년이라는 기간 동안 후속 관찰을 할 수 있었던 점에 대하여 앞으로 줄기세포 유래의 오가노이드가 조직재생 치료제로서 사용될 수 있는 많은 가능성을 보였지만 망막 오가노이드 이식에 의한 효과 검증에 대하여 더 복잡하고 다양한 분석 방식을 통하여 체계적인 분석이 뒷받침되어야 한다고 임상시험에 대한 평가를 하였다.
또 다른 오가노이드 임상 케이스로는 Yasuo Kurimoto 교수 연구팀에 이어 전 세계에서 두 번째로 오가노이드 이식에 대한 임상시험을 진행하고 있는 일본의 Watanebe Mamoru 교수 연구팀의 연구가 있다. Mamoru 교수 연구팀은 이전에 진행했던 전임상시험 결과를 바탕으로 8명의 환자에게서 장 성체줄기세포를 수득한 후 장 오가노이드를 제작해 2022년 7월에 이식하는 임상을 진행한 바 있다 [36]. 해당 연구팀의 임상시험은 자가유래 세포를 이용하기 때문에 면역거부반응으로부터 자유로우며, 내시경을 통한 비침습적 방식을 이용한 이식을 진행한다는 장점을 가지지만 임상 결과에 대한 보고는 아직 이루어지지 않았다.
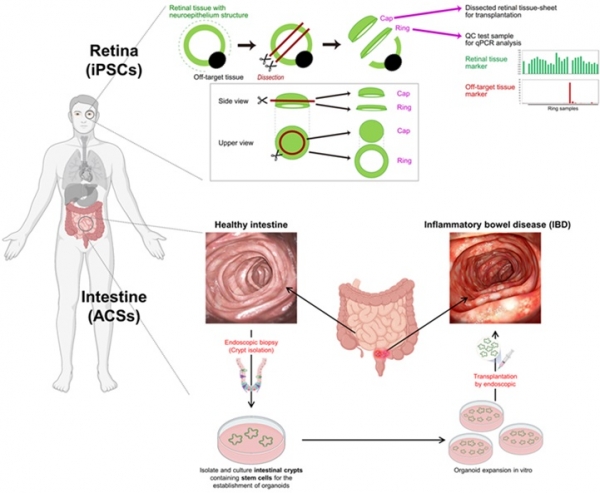
그림 6. 인간 줄기세포 유래 오가노이드를 이용한 조직재생 치료 임상 연구(참고문헌 [31]을 변형).
4. 결론
1990년대 후반 인간 배아 줄기세포의 발견과 함께 줄기세포 분야에 관한 활발한 연구가 시작되었으며 2000년대 유도만능줄기세포의 등장에 힘입어 전 세계적으로 줄기세포 연구에 관한 관심이 뜨거워졌다. 그리고 마침내 2009년 성체 줄기세포 유래의 장 오가노이드가 Hans Clevers 교수 연구팀에 의해 보고되면서 줄기세포를 활용한 오가노이드 연구의 장이 열렸다 [19,37-40]. 이후 전 세계 수많은 연구진들에 의해 인체 내에 존재하는 대부분의 장기에 대한 오가노이드 모델이 확립되었으며 현재는 다양한 질환 모델로 활발하게 사용되고 있는 중이다. 오가노이드 모델이 한계를 보일 때마다 다양한 공학 분야와의 공동연구로 그 한계를 극복해 나갔고 그 결과 이제는 조직재생 치료제로서 오가노이드의 임상실험이 진행 중이다 [3]. 최근에는 단일 장기 오가노이드 모델을 넘어 칩 기반의 다중장기 오가노이드 시스템과 오가노이드 접합을 통한 어셈블로이드(assembloid) 모델에 대한 활발한 연구가 진행되고 있다 [41]. 또한, 인공지능을 이용하여 오가노이드를 학습시켜 특정 패턴을 반복하는 완전히 새로운 연구 또한 보고된 바가 있는데, 이처럼 ‘오가노이드’라는 연구 분야는 이전의 10년 동안 이뤄낸 업적과 변화보다 앞으로의 10년 동안 이루게 될 업적과 변화들이 더 많을 것으로 예상된다 [42,43]. 그렇기 때문에 앞으로 어떤 기발한 아이디어들을 통하여 오가노이드 연구에 새로운 바람을 불러일으킬지 많은 귀추가 주목된다.
참고문헌
[1] Z. Zhao, X. Chen, A.M. Dowbaj, A. Sljukic, K. Bratlie, L. Lin, E.L.S. Fong, G.M. Balachander, Z. Chen, A. Soragni, M. Huch, Y.A. Zeng, Q. Wang, H. Yu, Organoids, Nat Rev Methods Primers 2 (2022).
[2] G. Rossi, A. Manfrin, M.P. Lutolf, Progress and potential in organoid research, Nat Rev Genet 19 (2018) 671-687.
[3] M.F. Tenreiro, M.A. Branco, J.P. Cotovio, J.M.S. Cabral, T.G. Fernandes, M.M. Diogo, Advancing organoid design through co-emergence, assembly, and bioengineering, Trends Biotechnol 41 (2023) 923-938.
[4] M. Hofer, M.P. Lutolf, Engineering organoids, Nat Rev Mater 6 (2021) 402-420.
[5] J. He, X. Zhang, X. Xia, M. Han, F. Li, C. Li, Y. Li, D. Gao, Organoid technology for tissue engineering, J Mol Cell Biol 12 (2020) 569-579.
[6] A. Sharma, S. Sances, M.J. Workman, C.N. Svendsen, Multi-lineage Human iPSC-Derived Platforms for Disease Modeling and Drug Discovery, Cell Stem Cell 26 (2020) 309-329.
[7] T. Takebe, K. Sekine, M. Enomura, H. Koike, M. Kimura, T. Ogaeri, R.R. Zhang, Y. Ueno, Y.W. Zheng, N. Koike, S. Aoyama, Y. Adachi, H. Taniguchi, Vascularized and functional human liver from an iPSC-derived organ bud transplant, Nature 499 (2013) 481-484.
[8] T. Takebe, R.R. Zhang, H. Koike, M. Kimura, E. Yoshizawa, M. Enomura, N. Koike, K. Sekine, H. Taniguchi, Generation of a vascularized and functional human liver from an iPSC-derived organ bud transplant, Nat Protoc 9 (2014) 396-409.
[9] T. Takebe, K. Sekine, M. Kimura, E. Yoshizawa, S. Ayano, M. Koido, S. Funayama, N. Nakanishi, T. Hisai, T. Kobayashi, T. Kasai, R. Kitada, A. Mori, H. Ayabe, Y. Ejiri, N. Amimoto, Y. Yamazaki, S. Ogawa, M. Ishikawa, Y. Kiyota, Y. Sato, K. Nozawa, S. Okamoto, Y. Ueno, H. Taniguchi, Massive and Reproducible Production of Liver Buds Entirely from Human Pluripotent Stem Cells, Cell Rep 21 (2017) 2661-2670.
[10] R. Ouchi, S. Togo, M. Kimura, T. Shinozawa, M. Koido, H. Koike, W. Thompson, R.A. Karns, C.N. Mayhew, P.S. McGrath, H.A. McCauley, R.R. Zhang, K. Lewis, S. Hakozaki, A. Ferguson, N. Saiki, Y. Yoneyama, I. Takeuchi, Y. Mabuchi, C. Akazawa, H.Y. Yoshikawa, J.M. Wells, T. Takebe, Modeling Steatohepatitis in Humans with Pluripotent Stem Cell-Derived Organoids, Cell Metab 30 (2019) 374-384 e376.
[11] R.R. Zhang, M. Koido, T. Tadokoro, R. Ouchi, T. Matsuno, Y. Ueno, K. Sekine, T. Takebe, H. Taniguchi, Human iPSC Derived Posterior Gut Progenitors Are Expandable and Capable of Forming Gut and Liver Organoids, Stem Cell Reports 10 (2018) 780-793.
[12] M. Kimura, T. Iguchi, K. Iwasawa, A. Dunn, W.L. Thompson, Y. Yoneyama, P. Chaturvedi, A.M. Zorn, M. Wintzinger, M. Quattrocelli, M. Watanabe-Chailland, G. Zhu, M. Fujimoto, M. Kumbaji, A. Kodaka, Y. Gindin, C. Chung, R.P. Myers, G.M. Subramanian, V. Hwa, T. Takebe, En masse organoid phenotyping informs metabolic-associated genetic susceptibility to NASH, Cell 185 (2022) 4216-4232 e4216.
[13] S.Y. Kang, M. Kimura, S. Shrestha, P. Lewis, S. Lee, Y. Cai, P. Joshi, P. Acharya, J. Liu, Y. Yang, J.G. Sanchez, S. Ayyagari, E. Alsberg, J.M. Wells, T. Takebe, M.Y. Lee, A Pillar and Perfusion Plate Platform for Robust Human Organoid Culture and Analysis, Adv Healthc Mater (2023) e2302502.
[14] E.A. Aisenbrey, W.L. Murphy, Synthetic alternatives to Matrigel, Nat Rev Mater 5 (2020) 539-551.
[15] L. Zhu, J. Yuhan, H. Yu, B. Zhang, K. Huang, L. Zhu, Decellularized Extracellular Matrix for Remodeling Bioengineering Organoid’s Microenvironment, Small 19 (2023) e2207752.
[16] S. Kim, S. Min, Y.S. Choi, S.H. Jo, J.H. Jung, K. Han, J. Kim, S. An, Y.W. Ji, Y.G. Kim, S.W. Cho, Tissue extracellular matrix hydrogels as alternatives to Matrigel for culturing gastrointestinal organoids, Nat Commun 13 (2022) 1692.
[17] G.G. Giobbe, C. Crowley, C. Luni, S. Campinoti, M. Khedr, K. Kretzschmar, M.M. De Santis, E. Zambaiti, F. Michielin, L. Meran, Q. Hu, G. van Son, L. Urbani, A. Manfredi, M. Giomo, S. Eaton, D. Cacchiarelli, V.S.W. Li, H. Clevers, P. Bonfanti, N. Elvassore, P. De Coppi, Extracellular matrix hydrogel derived from decellularized tissues enables endodermal
organoid culture, Nat Commun 10 (2019) 5658.
[18] N. Barker, M. Huch, P. Kujala, M. van de Wetering, H.J. Snippert, J.H. van Es, T. Sato, D.E. Stange, H. Begthel, M. van den Born, E. Danenberg, S. van den Brink, J. Korving, A. Abo, P.J. Peters, N. Wright, R. Poulsom, H. Clevers, Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro, Cell Stem Cell 6 (2010) 25-36.
[19] T. Sato, R.G. Vries, H.J. Snippert, M. van de Wetering, N. Barker, D.E. Stange, J.H. van Es, A. Abo, P. Kujala, P.J. Peters, H. Clevers, Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche, Nature 459 (2009) 262-265.
[20] M. Nikolaev, O. Mitrofanova, N. Broguiere, S. Geraldo, D. Dutta, Y. Tabata, B. Elci, N. Brandenberg, I. Kolotuev, N. Gjorevski, H. Clevers, M.P. Lutolf, Homeostatic mini-intestines through scaffold-guided organoid morphogenesis, Nature 585 (2020) 574-578.
[21] S.L. Giandomenico, S.B. Mierau, G.M. Gibbons, L.M.D. Wenger, L. Masullo, T. Sit, M. Sutcliffe, J. Boulanger, M. Tripodi, E. Derivery, O. Paulsen, A. Lakatos, M.A. Lancaster, Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output, Nat Neurosci 22 (2019) 669-679.
[22] M.A. Lancaster, J.A. Knoblich, Generation of cerebral organoids from human pluripotent stem cells, Nat Protoc 9 (2014) 2329-2340.
[23] A.N. Cho, Y. Jin, Y. An, J. Kim, Y.S. Choi, J.S. Lee, J. Kim, W.Y. Choi, D.J. Koo, W. Yu, G.E. Chang, D.Y. Kim, S.H. Jo, J. Kim, S.Y. Kim, Y.G. Kim, J.Y. Kim, N. Choi, E. Cheong, Y.J. Kim, H.S. Je, H.C. Kang, S.W. Cho, Microfluidic device with brain extracellular matrix promotes structural and functional maturation of human brain organoids, Nat Commun 12 (2021) 4730.
[24] H.A. Reza, R. Okabe, T. Takebe, Organoid transplant approaches for the liver, Transpl Int 34 (2021) 2031-2045.
[25] T. Tsuchida, S. Murata, S. Hasegawa, S. Mikami, S. Enosawa, H.C. Hsu, A. Fukuda, S. Okamoto, A. Mori, M. Matsuo, Y. Kawakatsu, H. Matsunari, K. Nakano, H. Nagashima, H. Taniguchi, Investigation of Clinical Safety of Human iPS Cell-Derived Liver Organoid Transplantation to Infantile Patients in Porcine Model, Cell Transplant 29 (2020) 963689720964384.
[26] T. Zou, L. Gao, Y. Zeng, Q. Li, Y. Li, S. Chen, X. Hu, X. Chen, C. Fu, H. Xu, Z.Q. Yin, Organoid-derived C-Kit(+)/SSEA4(-) human retinal progenitor cells promote a protective retinal microenvironment during transplantation in rodents, Nat Commun 10 (2019) 1205.
[27] Y. Xue, B. Lin, J.T. Chen, W.C. Tang, A.W. Browne, M.J. Seiler, The Prospects for Retinal Organoids in Treatment of Retinal Diseases, Asia Pac J Ophthalmol (Phila) 11 (2022) 314-327.
[28] S. Iraha, H.Y. Tu, S. Yamasaki, T. Kagawa, M. Goto, R. Takahashi, T. Watanabe, S. Sugita, S. Yonemura, G.A. Sunagawa, T. Matsuyama, M. Fujii, A. Kuwahara, A. Kishino, N. Koide, M. Eiraku, H. Tanihara, M. Takahashi, M. Mandai, Establishment of Immunodeficient Retinal Degeneration Model Mice and Functional Maturation of Human ESC-Derived Retinal Sheets after Transplantation, Stem Cell Reports 10 (2018) 1059-1074.
[29] H.Y. Tu, T. Watanabe, H. Shirai, S. Yamasaki, M. Kinoshita, K. Matsushita, T. Hashiguchi, H. Onoe, T. Matsuyama, A. Kuwahara, A. Kishino, T. Kimura, M. Eiraku, K. Suzuma, T. Kitaoka, M. Takahashi, M. Mandai, Medium- to long-term survival and functional examination of human iPSC-derived retinas in rat and primate models of retinal degeneration,
EBioMedicine 39 (2019) 562-574.
[30] E. Garreta, R.D. Kamm, S.M. Chuva de Sousa Lopes, M.A. Lancaster, R. Weiss, X. Trepat, I. Hyun, N. Montserrat, Rethinking organoid technology through bioengineering, Nat Mater 20 (2021) 145-155.
[31] P.E. Mulaudzi, H. Abrahamse, A. Crous, Insights on Three Dimensional Organoid Studies for Stem Cell Therapy in Regenerative Medicine, Stem Cell Rev Rep 20 (2024) 509-523.
[32] S. Sugimoto, E. Kobayashi, T. Kanai, T. Sato, In Vivo Intestinal Research Using Organoid Transplantation, Keio J Med 71 (2022) 73-81.
[33] X.Y. Tang, S. Wu, D. Wang, C. Chu, Y. Hong, M. Tao, H. Hu, M. Xu, X. Guo, Y. Liu, Human organoids in basic research and clinical applications, Signal Transduct Target Ther 7 (2022) 168.
[34] Y. Hirami, M. Mandai, S. Sugita, A. Maeda, T. Maeda, M. Yamamoto, H. Uyama, S. Yokota, M. Fujihara, M. Igeta, T. Daimon, K. Fujita, T. Ito, N. Shibatani, C. Morinaga, T. Hayama, A. Nakamura, K. Ueyama, K. Ono, H. Ohara, M. Fujiwara, S. Yamasaki, K. Watari, K. Bando, K. Kawabe, A. Ikeda, T. Kimura, A. Kuwahara, M. Takahashi, Y. Kurimoto,
Safety and stable survival of stem-cell-derived retinal organoid for 2 years in patients with retinitis pigmentosa, Cell Stem Cell 30 (2023) 1585-1596 e1586.
[35] K. Watari, S. Yamasaki, H.Y. Tu, M. Shikamura, T. Kamei, H. Adachi, T. Tochitani, Y. Kita, A. Nakamura, K. Ueyama, K. Ono, C. Morinaga, T. Matsuyama, J. Sho, M. Nakamura, M. Fujiwara, Y. Hori, A. Tanabe, R. Hirai, O. Terai, O. Ohno, H. Ohara, T. Hayama, A. Ikeda, D. Nukaya, K. Matsushita, M. Takahashi, A. Kishino, T. Kimura, S. Kawamata, M. Mandai, A. Kuwahara, Self-organization, quality control, and preclinical studies of human iPSC-derived retinal sheets for tissuetransplantation
therapy, Commun Biol 6 (2023) 164.
[36] S. Watanabe, S. Kobayashi, N. Ogasawara, R. Okamoto, T. Nakamura, M. Watanabe, K.B. Jensen, S. Yui, Transplantation of intestinal organoids into a mouse model of colitis, Nat Protoc 17 (2022) 649-671.
[37] J.A. Thomson, J. Kalishman, T.G. Golos, M. Durning, C.P. Harris, R.A. Becker, J.P. Hearn, Isolation of a primate embryonic stem cell line, Proc Natl Acad Sci U S A 92 (1995) 7844-7848.
[38] J.A. Thomson, J. Itskovitz-Eldor, S.S. Shapiro, M.A. Waknitz, J.J. Swiergiel, V.S. Marshall, J.M. Jones, Embryonic stem cell lines derived from human blastocysts, Science 282 (1998) 1145-1147.
[39] K. Takahashi, S. Yamanaka, Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, Cell 126 (2006) 663-676.
[40] K. Takahashi, K. Tanabe, M. Ohnuki, M. Narita, T. Ichisaka, K. Tomoda, S. Yamanaka, Induction of pluripotent stem cells from adult human fibroblasts by defined factors, Cell 131 (2007) 861-872.
[41] N. Vogt, Assembloids, Nat Methods 18 (2021) 27.
[42] L. Smirnova, B.S. Caffo, D.H. Gracias, Q. Huang, I.E. Morales Pantoja, B. Tang, D.J. Zack, C.A. Berlinicke, J.L. Boyd, T.D. Harris, E.C. Johnson, B.J. Kagan, J. Kahn, A.R. Muotri, B.L. Paulhamus, J.C. Schwamborn, J. Plotkin, A.S. Szalay,
J.T. Vogelstein, P.F. Worley, T. Hartung, Organoid intelligence (OI): the new frontier in biocomputing and intelligence-in-adish, Frontiers in Science 1 (2023).
[43] H. Cai, Z. Ao, C. Tian, Z. Wu, H. Liu, J. Tchieu, M. Gu, K. Mackie, F. Guo, Brain organoid reservoir computing for artificial intelligence, Nature Electronics 6 (2023) 1032-1039.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update