| 당뇨병 치료를 위한 췌도 오가노이드 개발 현황 | |
|---|---|
| Date 2024-04-29 16:50:51 |
|

교수 / 박사과정
성신여자대학교 바이오신약의과학부
dlim@sungshin.ac.kr / 220247048@sungshin.ac.kr
서론
생명공학 기술의 비약적인 발전으로 예전에는 상상하기 어려웠던 다양한 형태의 치료제가 개발되고 있다. 현대 사회에서 특히 두드러지게 증가하고 있는 대사성 질환인 당뇨병의 치료를 위해서도 생명공학 기술에 기반한 혁신적인 치료제들이 발굴되고 있다. 그 중에서도 제1형 당뇨병 및 후기의 제2형 당뇨병을 완전히 치료할 수 있는 세포 치료제 개발 기술이 업계의 커다란 주목을 받고 있다.
제1형 당뇨병에서는 자가면역 반응으로 인해 췌장 (pancreas) 내의 인슐린 생산 세포인 베타세포 (β cell)가 사멸하게 된다. 일부 선천성 당뇨병은 유전자 변이로 인해 베타세포가 인슐린을 생산할 수 없어서 발병한다. 이러한 경우 환자들은 반드시 인슐린을 투여받아야 한다. 한편, 제2형 당뇨병의 경우 질병이 후기로 진행되면서 결과적으로 베타세포의 사멸이 발생해 인슐린 투여가 반드시 필요한 경우가 존재한다. 하지만 인슐린을 매번 투여하는 방법은 상당히 번거로울 뿐 아니라, 체내의 베타세포가 수행하는 정도의 정밀한 혈당 조절이 불가능하다. 이에 따라 고혈당에 의한 부작용이 여전히 발생하며, 더욱 위험한 것은 치명적일 수 있는 저혈당증이 발생하는 환자의 비율이 상당히 높다는 점이다 (30-40%가량) [1,2].
이러한 인슐린 의존성 당뇨병을 치료하는 가장 이상적인 방법은 베타세포를 환자에 이식하는 것이다. 베타세포는 췌장의 췌도 (islet) 내에 위치하고 있으며, 장기 공여자로부터 췌도를 확보해 환자에 이식하는 치료법이 2000년대부터 개발되기 시작되어 2023년 마침내 미국 FDA의 승인을 획득하였다 [3]. 하지만 뇌사자로부터 기증받을 수 있는 췌장의 수가 극히 제한되어 있기 때문에, 새로운 방식으로 베타세포를 확보하기 위한 연구가 꾸준히 진행되고 있다.
다양한 종류의 세포를 시작 물질로 하여 베타세포를 제작하는 방법들이 개발되어 왔다. 예를 들어, 발생학적 기원이 유사한 또 다른 췌도 내분비 (endocrine) 세포인 알파세포 (α cell)를 베타세포로 전환 (trans-differentiation)시키는 기술이 연구되고 있다. 중간엽 줄기세포 (mesenchymal stem cells)의 분화를 통해 베타세포를 제작하는 것 역시 가능하다. 지금까지 가장 성공적으로 이용된 기술은 전분화능 줄기세포 (pluripotent stem cells)를 베타세포로 분화시키는 것이다. 배아 발생 연구를 통해 축적한 지식을 이용해 전분화능 줄기세포에 각종 단백질 인자들 및 화합물들을 처리해 세포 내 신호전달 경로를 조절하면 결과적으로 인슐린을 생산하는 베타세포를 제작할 수 있다 [4]. 본 글에서는 이러한 전분화능 줄기세포 유래 베타세포 (stem cell-derived β cell) 및 이를 바탕으로 제작된 췌도 오가노이드 (islet organoid)에 대해 논의할 것이다.
지금까지 제작된 전분화능 줄기세포 유래 베타세포들은 모두 인슐린을 생산하고 분비할 수 있다. 그럼에도, 이 세포들은 생체로부터 분리한 췌도 (primary islet) 내의 베타세포와는 생리학적으로 다른 점들이 존재하며, 결과적으로 췌도 내 베타세포들에 비해 포도당 감응 인슐린 분비 (glucose-stimulated insulin secretion) 기능이 현저히 부족하다는 문제점을 지니고 있다 [5]. 베타세포 치료제의 가장 중요한 기능이 생체 내 포도당 항상성 유지라는 점을 고려했을 때, 전분화능 줄기세포 유래 베타세포 제작 방식을 정교화하여 더 성숙된 (mature) 형태의 베타세포, 나아가 생체 내 췌도의 기능을 정확히 모사할 수 있는 췌도 오가노이드를 제작하려는 노력이 각지에서 진행되고 있다. 한편으로는, 당뇨병 세포치료제 개발의 시급성으로 인해 세포의 기능이 아직 완벽하지 않음에도 불구하고 전분화능 줄기세포 유래 베타세포를 이용한 임상시험이 본격적으로 진행되고 있다 [6].
본 기획특집에서는 현재의 당뇨병 세포치료제 개발 동향에 대해 먼저 논의할 것이다. 다음으로, 미래의 세포치료제 발굴을 위한 전분화능 줄기세포 유래 베타세포 및 췌도 오가노이드 연구 동향에 대해 다룰 것이다. 또한, 고성능의 세포치료제 개발을 위한 미래 연구 방향에 대해서도 논의할 것이다.
Lantidra: 최초로 FDA 승인을 획득한 당뇨병 세포치료제
췌도 이식 치료법 (Edmonton protocol)이 2000년에 처음 보고된 이후, 장기 공여자로부터 확보한 췌도를 제1형 당뇨병의 세포치료제로 적용하는 기술이 오랫동안 연구되었다. 그리고 마침내 2023년 6월에 미국 CellTrans 사의 췌도 이식 치료제인 Lantidra가 미국 FDA의 승인을 획득하였다 [3]. 임상 3상 시험 결과, 인슐린 투여를 통한 혈당 조절이 어려운 환자의 상당수(70%)에서 Lantidra의 장기 치료효과 (1년 이상)가 관찰되었고 최종적으로 승인을 받을 수 있게 된 것이다 [7]. 이 기념비적인 승인은 세포 기반 치료제의 성공 가능성을 극적으로 입증함과 동시에 많은 숙제들을 던져주었다.
Lantidra가 일반적인 당뇨병 치료제로 널리 사용되기에는 많은 제한점들이 있다. 먼저, 타인의 췌도를 간문맥 (portal vein)에 이식하는 것이기 때문에 이식된 세포에 대한 면역반응이 발생하게 되며, 이를 방지하기 위해 환자들은 면역억제제를 계속 투여받아야 한다. 면역억제제를 지속적으로 사용할 경우 단순 부작용을 넘어서 감염성질환 발생이나 암 발생과 같은 심각한 부작용이 발생할 가능성도 있다. 더욱 큰 한계점은 치료 효과를 위해서는 많은 양의 췌도를 환자에 이식해야 하며, 2회 이상의 췌도 이식이 요구되는 경우도 많다는 점이다. 이에 따라, 한 명의 환자에 이식할 췌도를 확보하기 위해서는 약 2-4 명의 장기 공여자로부터 공여받은 췌장이 필요하다 [7]. 결국 Lantidra의 치료 효과를 누릴 수 있는 환자의 수가 극히 제한적이라는 약점이 필연적으로 존재한다. 치료제의 공급이 제한되어 있으며 특수한 치료법이 요구된다는 사실 때문에 치료 비용도 매우 높을 것으로 예상된다 (환자당 30만 달러 가량). 따라서 무한대로 공급될 수 있는 전분화능 줄기세포 유래 베타세포를 제작하기 위한 기술이 널리 연구되고 있다.
전분화능 줄기세포 유래 베타세포 제작 기술 현황
2014년에 Harvard 대학의 Douglas Melton 그룹 및 British Columbia 대학의 Timothy Kieffer 그룹이 각각 발표한 핵심 프로토콜을 바탕으로 전분화능 줄기세포 유래 베타세포를 제작하는 연구가 활발히 진행되고 있다 (그림 1) [8,9]. 이 기술은 배아로부터 베타세포가 발생하는 과정을 실험실 세포 배양 환경에서 모사하여 배아줄기세포나 유도만능줄기세포를 베타세포로 분화시키는 방법이다. 다양한 단백질들과 저분자 화합물들의 조합을 통해 세포 신호 경로 (cellular signaling pathway)를 조절하면, 줄기세포가 분화되는 방향을 조절하여 결과적으로 베타세포를 얻을 수 있게 된다.
예를 들어, 분화의 첫 단계에서는 activin A 단백질과 GSK3 저해제를 적용해 내배엽 (definitive endoderm) 세포를 만들어 낸다. Fibroblast growth factor-7 (FGF-7)은 원시장관 (primitive gut tube)을 거쳐 췌장 전구체 (pancreatic progenitor)로의 분화에 핵심적인 역할을 하는 단백질이다. Bone morphogenetic pathway의 저해제인 LDN193189는 췌장 세포들 중에서도 내분비 세포로의 전환을 유도한다. ALK5의 저해제인 Alk5i와 타이로이드 호르몬인 T3는 내분비 세포들 중에서도 베타세포로의 전환을 촉진한다. 이 외에도 다양한 조합의 물질들을 이용해 결과적으로 인슐린을 생산하는 베타세포를 제작하게 된다 (그림 1) [8,9].
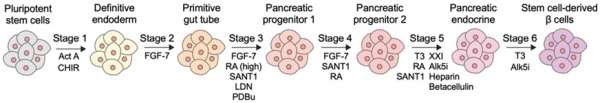
그림 1. 전분화능 줄기세포 유래 베타세포의 제작을 위한 프로토콜.
이상의 기본 프로토콜을 통해 제작된 베타세포들은 인슐린을 생산하고 분비할 수 있음에도 불구하고, 포도당 감응 인슐린 분비 능력이 현저히 부족해 온전한 치료제로 사용되기는 어려웠다. 또한 최종 분화 산물은 순수한 베타세포가 아닌 각종 세포들의 혼합물 형태로 존재한다. 이 혼합물 중에서 베타세포의 비율은 여전히 낮은 편이며, 대신 생체 내의 췌도에는 존재하지 않는 다호르몬 분비 세포 (polyhormonal cells: 인슐린과 글루카콘을 모두 분비하는 세포)들이 많이 만들어진다는 문제도 있다. 따라서 신규 분화 인자 도입 및 분화 인자 재조합을 통한 프로토콜의 고도화를 통해 더 우수한 성능의 전분화능 줄기세포 유래 베타세포를 제작하기 위한 기술이 계속하여 개발되고 있다 [10,11].
현재의 기술로 제작된 전분화능 줄기세포 유래 베타세포의 특징을 정확히 파악하면 프로토콜 개선 방향을 결정할 수 있다. 예를 들어, RNA sequencing 기반의 유전자 발현 분석 연구를 통해 제작된 세포들의 특성을 파악할 수 있다. 이에 따르면, 현재의 전분화능 줄기세포 유래 베타세포에서는 포도당 대사 능력이 현저히 저하되어 있고 결과적으로 포도당 감응 인슐린 분비가 적절히 이루어지지 않는다 [12,13]. 따라서, 포도당 대사 능력이 향상된 세포를 제작해야 하는 것이 앞으로의 주요 과제임을 확인할 수 있다.
아직까지도 분화를 통한 베타세포 제작 연구는 초기 단계에 머물러 있기 때문에, 조직화된 접근보다는 각 연구그룹 별로 별개의 연구를 수행하여 베타세포의 기능을 높이려는 시도들이 진행되고 있다. 그럼에도 의미 있는 결과가 꾸준히 확보되고 있으며, 이러한 연구 노력들을 종합하면 우수한 성능의 세포를 제작할 수 있는 프로토콜이 머지 않아 확립될 것이라 기대한다.
췌도 오가노이드 제작 기술 현황
줄기세포 분화 기술의 발전에 따라, 단순히 베타세포를 제작하는 것을 넘어서 세포를 3차원 형태의 고도화된 조직체로 변환시켜 궁극적으로 생체 내의 췌도와 같은 구조 및 기능을 갖는 오가노이드를 제작하기 위한 연구가 수행되고 있다. 베타세포는 췌도 내에서 단독으로 존재하는 것이 아니라 다른 내분비 세포인 알파세포, 델타세포 (δ cells) 및 PP 세포 (pancreatic polypeptide cell)와 어우러져 존재하며, 이 세포들과의 상호작용이 베타세포의 기능 유지에 매우 중요하다는 사실은 이미 잘 알려져 있다. 또한, 췌도는 혈관화 (vascularization)가 매우 잘 이루어진 조직이다. 이는 췌도 내 세포들의 대사가 활발하기 때문에 산소 및 영양분을 충분히 공급해주기 위함이다. 혈중 포도당 농도를 민감하게 감지하기 위해서도 혈관화가 중요하다. 따라서, 온전한 췌도 오가노이드에는 내피세포 (endothelial cell) 역시 적절히 포함되어야 한다 [14]. 이렇게 실제 췌도의 조성을 완벽히 모사할 수 있는 전분화능 줄기세포 유래 췌도의 제작은 아직까지 이루어지지 못했지만, 그럼에도 3차원 조직체의 제작을 통해 고성능의 치료제를 확보하려는 노력이 꾸준히 진행되고 있다.
3차원 췌도 조직체의 제작을 위한 가장 기본적인 방법은 세포들 각각을 분리 (dissociation) 시킨 후, 이들이 스스로 재응집 (self-aggregation)하도록 유도하는 것이다. 가장 기본적인 방식은 전분화능 줄기세포를 3차원 조직체로 변환시킨 후 이들을 그대로 분화시켜 3차원 췌도 조직체를 확보하는 것이다. 반대로 분화가 완료된 세포의 분리 및 재응집 과정을 통해 3차원 췌도 조직체를 확보할 수도 있다. 대표적인 예로, 분화 후에 인슐린을 생산하는 세포만을 분리 정제하고, 이들을 3차원 형태의 조직체로 변환시키면 세포의 인슐린 분비능이 획기적으로 향상된다는 연구 결과가 발표되기도 하였다 [15]. 이는 세포의 분화뿐만 아니라 세포 조직화 방식 역시 세포의 기능 유지에 매우 중요한 요소임을 입증한다. 이에 따라 세포 외 기질 (extracellular matrix)이나 고분자 기반 생체재료 (biomaterial)가 존재하는 환경에서 세포의 분화 및 3차원 응집을 수행하여 췌도 오가노이드에 한 걸음 더 다가가기 위한 조직체 제작 연구 역시 꾸준히 진행되고 있다 [16].
3차원 조직체를 제작하는 기술 자체는 상당히 발전했음에도 실제 췌도를 모사하는 고기능성 오가노이드를 제작하는 데에는 아직 커다란 한계가 있는데, 이는 바로 췌도를 구성하는 다양한 내분비 세포들을 순수하게 확보하기가 어렵기 때문이다. 전분화능 줄기세포의 분화를 통해 확보된 세포에는 베타세포 뿐 아니라 글루카곤을 분비하는 알파세포가 일부 존재하며, 상당수의 세포는 인슐린과 글루카곤을 동시에 분비하는 미성숙 세포이다. 또한 그 특성을 정확히 파악하기 어려운 세포 군집도 상당수 존재한다. 앞서 언급한대로 인간의 췌도에는 각 내분비 세포들이 특정 비율로 존재하기 때문에, 장기적으로는 각 세포들을 높은 순도로 생산하고 이들을 응집시키는 것이 필요하다. 이러한 노력의 일환으로, 전분화능 줄기세포의 분화를 통해 순수한 알파세포를 제작하는 방법 역시 개발되고 있다 [17]. 또한 세포 분화를 통해 확보한 내분비 세포 혼합물에서 베타세포와 알파세포를 선택적으로 분리할 수 있는 형광 센서 및 이를 적용한 세포 분리 정제 기술 개발도 이루어지고 있다 [18]. 순수한 델타세포나 PP세포를 확보하기 위한 작업은 비교적 더딘 상황이다. 아직 걸음마 단계이지만 전세계적으로 많은 노력이 진행되고 있기에, 머지않아 고기능성 췌도 오가노이드의 제작이 이루어질 것이라 기대한다.
당뇨병 세포치료제의 성능 향상을 위한 최신 생명공학 기술 도입 현황
전분화능 줄기세포에서 유래한 재생 치료제의 가장 큰 장점은 유전자 편집 및 유전자 전달로 치료제의 기능을 향상시킬 수 있다는 점이다. 특히 CRISPR-Cas9에 기반한 줄기세포 유전자 편집 기술이 잘 확립되어 있기 때문에, 결과적으로 유전자 편집이 이루어진 전분화능 줄기세포 유래 베타세포 및 췌도 오가노이드를 제작할 수 있다 [19,20]. 실제로 현재의 세포이식 치료법의 문제를 해결하기 위한 유전자 편집 기술이 개발되었고, 일부 치료제는 임상시험에도 돌입해 있다.
가장 대표적인 예로, 이식된 세포에 대한 면역 거부반응 때문에 면역억제제를 계속 투여받아야 한다는 문제점을 해결하기 위해 면역회피 (hypoimmune) 줄기세포가 제작되어 이용되고 있다. MHC class I 및 class II 복합체가 이식된 세포의 면역 거부반응에 관여하는 핵심 분자들이기 때문에, 이들의 생성을 제거하기 위한 목적으로 B2M 유전자 및 CIITA 유전자를 knock-out 시킨 면역회피 줄기세포가 제작되었다. 이에 더해, 면역 회피 성능을 더욱 높이기 위해서 바이러스 벡터를 이용해 CD47를 과발현시키는 전략 등도 함께 이용되고 있다 [21]. 이외에도 다양한 조합의 유전자 제거 및 도입 전략을 통해 면역회피 기능을 갖는 세포들이 제작되고 있다. 이렇게 엔지니어링 된 전분화능 줄기세포를 분화시켜 다양한 면역회피 세포치료제가 제작되고 있으며, 실제로 줄기세포 유래 베타세포 역시 제작되어 동물 모델에서의 효능이 검증되었고 임상시험도 진행되고 있다 [22].
한편, 면역억제제 투여를 회피하기 위해 세포를 디바이스 (device)에 봉입 (encapsulation)해 이식하는 것 역시 주요한 기술이다. 반투막 멤브레인 (semi-permeable membrane)으로 제작된 디바이스는 산소, 영양분 및 단백질과 같은 분자들은 통과시키지만 면역세포는 통과시키지 못하여, 췌도세포의 작용은 유지하면서도 면역세포의 접근은 차단할 수 있는 도구이다. 따라서 디바이스에 담긴 세포를 이식하면 면역억제를 사용하지 않는 안전한 치료가 가능하며, 실제로 디바이스 기반 치료법에 대한 임상시험이 꾸준히 진행되어 왔다. 다만, 디바이스를 외부물질로 인식하는 체내 이물반응 (foreign body response)에 의한 디바이스 섬유화 (fibrosis), 그리고 이에 따른 디바이스 기능 저하가 장기 치료 효과를 막는 주요한 문제이다. 또한 디바이스 내부로의 산소 전달이 제한적이라 특히 산소요구량이 높은 베타세포의 사멸이 발생하는 경우가 많다 [6,23]. 이러한 문제들이 해결될 경우, 디바이스 기반 세포치료제 이식은 장기 치료를 위한 우수한 대안이 될 것이다.
전분화능 줄기세포 유래 베타세포를 이용한 임상시험 현황
지금까지 논의한 세포 제작 기술, 유전자 편집 기술 및 세포 이식 기술을 바탕으로 전분화능 줄기세포 유래 베타세포를 이용한 제1형 당뇨병 치료 임상시험이 꾸준히 진행되고 있다. 미국 Viacyte 사에 의해 진행된 초창기 임상시험들에서는 완벽히 분화된 베타세포 제작 기술이 부족했기 때문에 분화의 중간 단계인 췌장 내배엽 (pancreatic endoderm) 상태의 세포 (PEC-01)를 이식하고, 이들이 생체 내에서 최종적으로 분화되도록 (in vivo maturation) 유도하였다. 해당 임상시험들에서는 세포를 면역 반응으로부터 보호하고, 필요한 경우 이식된 세포의 제거 (retrieval)를 가능케 하는 디바이스를 이용해 이식을 수행하였다. 초창기 임상시험에서는 이식된 치료제의 생착 (engraftment)이 제대로 이루어지지 않아 치료 효과를 거의 관찰하지 못하였다 (NCT02239354, NCT04678557). 주된 이유는 디바이스에 대한 혈관화 (vascularization)가 제대로 이루어지지 않아 산소와 영양분들의 전달이 어렵다는 것, 그리고 디바이스에 대한 이물 반응으로 섬유화가 광범위하게 일어나 결국 디바이스 내외로의 물질 전달이 막힌다는 점이었다.
이상의 문제를 해결하고자, 혈관화를 용이하게 하기 위한 목적으로 구멍이 뚫려 있어 (perforated) 열린 디바이스를 이용한 임상시험이 진행되었다 (NCT03163511). 이러한 경우에는 면역억제제를 함께 사용하여 이식된 세포를 보호하였다. 최근 보고된 임상시험 결과에 따르면, 일부 환자들에서 (30-40%) 확실한 혈당 조절 효과 및 중장기 (6개월 이상) 치료 효과도 관찰되었으며, 실제로 이식된 췌장 내배엽 세포 (PEC-01)의 일부가 인슐린을 생산하는 베타세포로 전환된 것 역시 확인할 수 있었다. 다만, 여전히 베타세포로의 최종 분화 효율이 낮으며, 치료 효과를 관찰할 수 없는 환자들도 많고, 또한 디바이스의 섬유화가 대부분 관찰되어 앞으로 해결해야 할 과제를 분명히 알려주었다. 그럼에도 치료 효과가 관찰되었다는 사실은 앞으로의 신규 치료제 개발에 대한 희망을 갖게 하기에 충분하다 [24].
최근의 임상시험에서는 최종적으로 분화된 줄기세포 유래 베타세포를 이용하고 있다. Vertex 사의 주도로 현재 진행되고 있는 시험에서는 Lantidra와 마찬가지로 간문맥에 세포를 이식하고 면역억제제를 함께 투여해 준다 (NCT04786262). 현재까지 보고된 중간 결과에 따르면 이식된 세포의 생착 및 혈당 감소 효과가 관찰되었다. 한편으로는 최종 분화된 세포를 디바이스에 봉입하여 면역억제제 없이 이식하는 치료법에 대한 임상 시험 역시 Vertex 사에 의해 수행되고 있다 (NCT05791201).
표 1. 줄기세포 유래 베타세포 기반 임상시험 현황
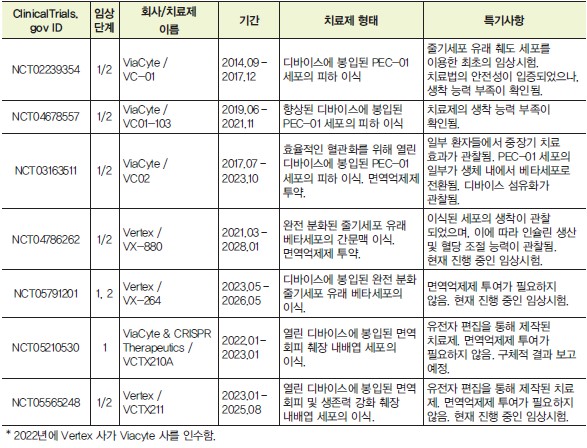
면역억제제에 투여에 의한 부작용이 흔히 관찰되기 때문에, 최근 들어 CRISPR-Cas9 기반 유전자 편집을 통해 면역회피 줄기세포를 제작하고, 이의 분화를 통해 췌도 세포를 제작하여 이식하는 기술이 연구되고 있다. 앞서 언급한대로 MHC 복합체의 작용을 억제하기 위한 유전자 편집을 수행하여 면역회피 줄기세포가 제작되었다. 이에 더해, 유전자 추가 도입을 통해 면역회피 기능을 강화하고 세포의 생존력을 향상시키는 엔지니어링을 수행할 수도 있다. 이렇게 제작된 줄기세포들을 분화시켜 췌장 내배엽세포를 확보하고 디바이스를 통한 세포 이식을 이용하는 치료법이 현재 임상시험에 돌입해 있다 (NCT05210530, NCT05565248).
미래 기술 개발 현황
이상의 임상시험 결과를 살펴 보았을 때, 전분화능 줄기세포 유래 베타세포가 당뇨병 치료 효과를 보일 수 있음은 명백한 사실이다. 하지만, 아직까지는 일부의 환자들에서만 우수한 치료 효과를 보였고, 또한 장기치료 효과 검증 작업이 더 필요한 상황이다. 현재까지 진행된 임상시험에서 밝혀진 문제점들을 파악하면 미래 기술 개발의 방향을 결정할 수 있을 것이다.
먼저 포도당 감응 인슐린 분비 기능이 우수한 세포를 개발하는 것이 가장 중요하다. 체내 포도당 항상성 유지를 위해서는 필요한 순간에 필요한 양의 인슐린이 분비되어야 하기에, 해당 기능을 갖는 조직체를 제작하는 것이 최우선 과제이며 이를 위한 분화 프로토콜의 개발이 꾸준히 진행되어야 할 것이다. 궁극적으로는 고기능성 췌도 오가노이드 제작이 반드시 필요하며, 이를 위해서는 췌도를 이루는 핵심 요소인 베타세포, 알파세포, 델타세포 및 PP세포들을 생산하고 이를 재조합하는 기술의 개발이 요구된다.
면역 거부반응이 없는 치료제 개발을 위해서는 최적의 세포 봉입 디바이스 발굴이 요구된다. 특히 지금까지의 임상시험에서 어김없이 관찰된 섬유화를 일으키지 않는 디바이스의 제작이 반드시 필요하다. 또한 산소 전달능력이 개선되어 세포의 장기 생존을 가능케 하는 디바이스의 제작도 매우 중요하다. 면역회피 줄기세포 유래 세포치료제를 적용할 경우, 디바이스 없이 치료효과를 누릴 수 있다는 장점이 있지만 면역회피에 따르는 잠재적 위험성 (예: 종양 형성)을 반드시 고려해야한다. 이 경우, 세포치료제의 생존을 조절할 수 있는 안전 장치 (safety switch)의 도입이 반드시 요구된다.
치료제가 널리 이용되기 위해서는 세포를 대량으로 생산할 수 있는 기술이 반드시 필요하다. 분화가 완료된 베타세포는 세포분열에 의한 성장을 하지 못하기 때문에, 세포의 일시적 증식을 통해 세포의 절대량을 늘려 세포 생산 비용을 절감하는 것 역시 매우 중요한 과제이다.
이상의 과제들을 해결하기 위한 연구들은 이미 활발하게 진행되고 있으며, 당뇨병 완전한 치료를 위한 혁신 치료제의 개발이 절실하기에 기술 개발이 빠른 속도로 이루어질 것으로 기대한다.
참고문헌
(1) Nair, G.G. et al. Emerging routes to the generation of functional β-cells for diabetes mellitus cell therapy. Nat. Rev. Endocrinol. 2020, 16, 506−518.
(2) Jang, S. et al. Genome editing for engineering stem cell-derived pancreatic β cells: recent trends and future perspectives. Organoid 2023, 3, e17.
(3) First cell therapy for diabetes approved. Nat. Biotechnol. 2023, 41, 1036.
(4) Hogrebe, N.J. et al. Developments in stem cell-derived islet replacement therapy for treating type 1 diabetes. Cell Stem Cell 2023, 30, 530−548.
(5) Veres, A. et al. Charting cellular identity during human in vitro β-cell differentiation. Nature 2019, 569, 368−373.
(6) Basile, G. et al. Emerging diabetes therapies: Bringing back the β-cells. Mol. Metab. 2022, 60, 101477.
(7) https://www.fda.gov/vaccines-blood-biologics/lantidra
(8) Pagliuca, F.W. et al. Generation of functional human pancreatic β cells in vitro. Cell 2014, 159, 428−439.
(9) Rezania, A. et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotechnol. 2014, 32, 1121−1133.
(10) Hogrebe, N.J. et al. Targeting the cytoskeleton to direct pancreatic differentiation of human pluripotent stem cells. Nat. Biotechnol. 2020, 38, 460−470.
(11) Balboa, D. et al. Functional, metabolic and transcriptional maturation of human pancreatic islets derived from stem cells. Nat. Biotechnol. 2022, 40, 1042−1055.
(12) Barsby, T. et al. Aberrant metabolite trafficking and fuel sensitivity in human pluripotent stem cell-derived islets. Cell Rep. 2023, 42, 112970.
(13) Davis, J.C. et al. Glucose Response by Stem Cell-Derived β Cells In Vitro Is Inhibited by a Bottleneck in Glycolysis. Cell Rep. 2020, 31, 107623.
(14) Lammert, E.; Thorn, P. The Role of the Islet Niche on Beta Cell Structure and Function. J. Mol. Biol. 2020, 432, 1407−1418.
(15) Nair, G.G. et al. Recapitulating endocrine cell clustering in culture promotes maturation of human stem-cell-derived β cells. Nat. Cell Biol. 2019, 21, 263−274.
(16) Jiang, L. et al. Making human pancreatic islet organoids: Progresses on the cell origins, biomaterials and threedimensional technologies. Theranostics 2022, 12, 1537−1556.
(17) Peterson, Q.P. et al. A method for the generation of human stem cell-derived alpha cells. Nat. Commun. 2020, 11, 2241.
(18) Kahraman, S. et al. Fluorescein-based sensors to purify human α-cells for functional and transcriptomic analyses. eLife, 2023, 12, e85056.
(19) Lim, D. et al. Engineering designer beta cells with a CRISPR-Cas9 conjugation platform Nat. Commun. 2020, 11, 4043.
(20) Modell, A. E. et al. CRISPR-based therapeutics: current challenges and future applications. Trends Pharmacol. Sci. 2022, 43, 151−161.
(21) Hu, X. et al. Hypoimmune induced pluripotent stem cells survive long term in fully immunocompetent, allogeneic rhesus macaques. Nat. Biotechnol. 2024, in press.
(22) https://classic.clinicaltrials.gov/ct2/show/NCT05210530.
(23) Yang, K. et al. A therapeutic convection-enhanced macroencapsulation device for enhancing β cell viability and insulin secretion. Proc. Natl. Acad. Sci. USA 2021, 118, e2101258118.
(24) Keymeulen, B. et al. Encapsulated stem cell–derived β cells exert glucose control in patients with type 1 diabetes. Nat. Biotechnol., 2024, in press.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
