| 탈세포화 기술을 활용한 오가노이드 연구 | |
|---|---|
| Date 2024-04-29 16:15:33 |
|

책임연구원
㈜로킷헬스케어 장기재생부문
jina.ryu@rokit.co.kr
1. 서론
오가노이드(Organoid)는 최근 의학 및 생명과학 분야에서 혁신적인 기술로 주목을 받고 있다. 이러한 3D 세포 구조물은 재생의학, 질병 모델링, 약물 개발 등 다양한 분야에서의 응용할 수 있는 가능성을 가지고 있으며, 기존의 2D 배양 세포 플랫폼보다 인체의 생리학적 특성을 유사하게 모방할 수 있다는 장점을 가지고 있다.
그러나 오가노이드를 임상에 활용하기 위해서는 몇 가지 도전과제가 존재한다. 먼저 오가노이드를 구성하는 세포의 종류와 수가 현실적인 생체 조직을 완벽하게 모방하지 못하며, 조직 구조의 복잡성도 매우 다르다. 오가노이드 제작에 있어 재현성이 보장되지 않으면, 다양한 연구실에서 일관된 결과를 얻는 것을 어렵게 만들어 대규모 생산 및 확장 배양이 제한된다. 또한 오가노이드 3D 구조물에 영양 공급 및 폐기물 배출을 위한 신생 혈관의 생성은 중요한 이슈다. 이러한 원인들로 인해 오가노이드의 크기는 제한이 되며 장기배양(Long-term culture) 역시 여전히 극복하지 못한 과제로 남아있다.
이러한 한계를 극복하여 오가노이드를 활용하기 위해 최근에는 다양한 생체물질을 접목하고 있다. 이는 오가노이드를 구성하는 세포의 다양성과 그 기능을 더욱 생체와 가깝게 모사하려는 시도라고 할 수 있다. 특히, 탈세포화(Decellularization)는 세포를 제거하면서도 세포외기질(Extracellular matrix, ECM)을 보존하는 기술로, 이를 이용하여 만든 하이드로겔(Hydrogel)은 기존 오가노이드 연구에서 사용하는 마트리겔(Matrigel)을 대체할 수 있다 (그림 1). 마트리겔은 마우스의 육종에서 추출한 세포외기질로 주로 라미닌과 같은 종양 ECM 성분으로 구성되어 있어 오가노이드 배양에 각 조직의 특이적 ECM을 제공하지 못한다. 또한 마트리겔은 정의되지 않은 다양한 단백질로 구성되어 있기 때문에 이를 이용해 배양한 오가노이드 배치 간의 차이가 발생하기도 한다. 이러한 이유로 인하여 마트리겔의 대체물질을 개발하기 위한 시도들이 이루어지고 있다.
최근 연구에서는 다양한 조직과 장기에서 얻은 탈세포화 세포외기질(Decellularized extracellular matrix, dECM)을 이용하여 오가노이드의 형성 및 분화를 촉진하는 방안들이 연구되고 있다. 이러한 연구들은 오가노이드 기술의 한계를 극복하고, 의학 및 생명과학 분야에서 보다 현실적이고 효과적인 응용 가능성을 제시할 것으로 기대된다. 본 기고는 이러한 탈세포화 기술을 활용한 오가노이드에 대한 최신 연구 동향과 전망을 논의하고자 한다.
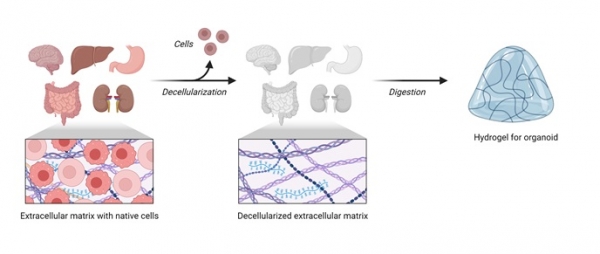
그림 1. 장기의 탈세포화 세포외기질로 만들어지는 오가노이드 배양용 하이드로겔.
2. 본론
탈세포화 기술을 통해 얻어지는 dECM은 조직 별 특이 단백질을 가지며 오가노이드 세포의 성장 및 분화에 영향을 미친다. 다양한 조직 및 장기에서 유래한 dECM이 조직 공학 응용 분야에서 활용되고 있으며, 탈세포화는 방법에 따라 물리적, 화학적, 생물적(효소) 방법으로 구분된다.
탈세포화를 위한 방법들
화학적 탈세포화는 계면활성제를 사용하는 방법이 가장 흔히 알려져 있다. 이온성 계면활성제(예, Sodium dodecyl sulfate, SDS)는 세포외기질 사슬을 절단하여 세포막과 핵막을 용해시켜 DNA를 분리한다 [1]. 그러나 이온성 계면활성제에 오랫동안 노출되면 세포외기질에 손상을 입힐 수 있으므로 탈세포화에 있어 적절한 농도와 시간 조절이 필요하다. 비이온성 계면활성제(예, Triton X-100)도 세포막을 용해하여 DNA를 분리하지만 단백질의 결합을 끊지 않기 때문에 비교적 세포외기질의 손상이 적은 반면 DNA제거가 완벽하지 않을 수 있다 [2]. 그 외에도 양쪽성이온 계면활성제(예, CHAPS), 산ᆞ염기성 용액, 저삼투성ᆞ고장성 용액을 이용한 탈세포화 방법이 알려져 있다 [3,4].
물리적 탈세포화는 온도, 힘, 압력 등을 이용하여 세포를 장기 및 조직에서 효과적으로 제거할 수 있다. 최근에는 초임계 유체(Supercritical fluids)를 이용한 탈세포화 방법이 주목을 받고 있으며, 이러한 방법은 탈세포화에 소모되는 시간과 비용을 줄여 대량의 탈세포화가 가능하게 한다 [5,6]. 그 외에도 물리적 탈세포화는 동결ᆞ해동의 반복을 통해 세포막을 파괴하는 방법과 전기 및 가압을 통해 세포를 제거하는 방법 등이 알려졌다 [7-9]. 이러한 물리적인 방법은 세포가 제거된 후에도 세포의 부산물이 완전히 제거되지 않기 때문에 추가적인 세척과정이 필요하며, 방법에 따라 특수 장비가 필요하기도 하다.
생물적 탈세포화는 주로 효소를 사용하여 이루어지는데, DNA·RNA의 가수 분해를 촉진하여 세포를 용해하는 뉴클레아제(Nuclease), 세포부착 단백질 결합을 제거하는 트립신(Trypsin), 특정 단백질의 결합을 제거하는 디스파제(Dispase)를 대표적으로 들 수 있다 [10,11]. 이러한 방법은 세포 및 특정 단백질에 특이적으로 반응하여 세포제거에 효과적이지만 시간과 비용이 많이 소요되므로 단독 사용보다는 주로 화학적, 물리적 탈세포화와 함께 사용된다.
탈세포화 dECM을 사용하여 생성한 오가노이드 사례들
2024년 2월을 기준으로 Google scholar에서 “Organoid”, “Decellularization”을 검색하면 약 9,080개의 검색결과가 나온다. 날짜를 제한하여 2020년부터로 같은 검색어를 넣으면 약 5,360개의 검색결과가 나온다. 발표된 연구논문의 절반 이상이 최근 4년간 나온 연구결과이다. 연구 그룹도 나라도 다양하다. 이렇듯 탈세포화 기술을 활용한 dECM을 오가노이드 연구에 적용하려는 시도들이 일어나고 있다.
돼지의 소장(Small intestine) 점막을 탈세포화 하여 얻은 dECM으로부터 하이드로겔을 생성하여 소장, 간, 위, 췌장과 같은 내배엽(Endodermal) 유래 조직 오가노이드의 배양에 적용한 연구결과가 보고됐다 [12]. 이러한 dECM 하이드로겔은 마트리겔과 유사한 수준의 콜라겐 Ⅰ, Ⅲ, Ⅳ를 포함하며, 유변학적(Rheological) 프로파일 및 탄성계수(Elastic modulus)도 유사하여 마트리겔을 대체할 수 있는 물질로의 가능성이 확인되었다.
위장(Gastrointestinal, GI) 오가노이드를 배양하기 위해 돼지의 위와 소장 조직을 탈세포화 하여 이를 하이드로겔 형태로 만들었다 [13]. 탈세포화를 통해 얻어진 dECM은 마트리겔에 비해 각 조직의 특이적 단백질을 훨씬 더 많이 포함하는 것으로 분석되었다. 또한 마트리겔을 대체할 가능성을 조사하기 위하여 마트리겔을 이용하여 생성한 오가노이드와 dECM 하이드로겔을 이용하여 생성한 오가노이드를 비교, 분석하였다. 그 결과 형태학적 발달은 유사하였으나 dECM은 특이적인 단백질을 포함하여 장 오가노이드의 성장 및 발달을 촉진시키는 것을 관찰하였다.
뇌(Brain) 오가노이드 제작을 위해 돼지의 뇌를 탈세포화하여 dECM을 얻은 연구도 있다 [14]. 연구팀은 뇌 오가노이드의 제작을 위하여 뇌 dECM에 인간 배아줄기세포(hESC)를 배양했으며, 이렇게 생성된 오가노이드는 기존 마트리겔에서 생성된 뇌 오가노이드에서는 발견되지 않았던 뇌실 유사부분의 형성을 보였으며, 이는 뇌 특이적 dECM이 뇌 오가노이드의 신경 외피 발달에 기여한 것으로 보였다. 또한 마트리겔의 오가노이드와는 달리 dECM 오가노이드에서는 Neural budding이 없이 세포의 균질한 성장이 발견되었다.
콩팥(Kidney) 오가노이드 생성에 dECM이 미치는 영향을 연구한 결과가 보고됐다 [15]. 연구팀은 콩팥을 탈세포화하였고 이로부터 생성된 dECM 하이드로겔을 이용하여 인간 만능줄기세포(hPSC) 유래 콩팥 오가노이드를 생성하였다. 또한 오가노이드의 발달에 대한 dECM의 효과를 확인하기 위하여 dECM기반의 두 가지 프로토콜(Protocol A, B)과 마트리겔기반의 오가노이드와의 비교 분석을 진행하였다 (그림 2). 그 결과 dECM을 사용하여 배양한 오가노이드는 혈관 네트워크 형성이 강화되며 사구체 발달의 성숙한 패턴을 보였다. 또한 단세포 RNA sequencing을 통해 분석한 결과에서도 콩팥 dECM을 통해 만들어진 오가노이드에서 콩팥의 발달과 관련된 유전자들의 발현이 증가하며, 특히 네프론 세포의 비율이 증가함을 확인하였다.
이식에 적합 판정을 받지 못한 인간의 간을 윤리위원회의 승인을 거쳐 탈세포화 한 연구 결과도 있다 [16]. 연구진은 오가노이드의 초기 배양을 위해 생검(Biopsy)을 통해 얻은 인간의 간세포를 사용하였으며, 간 dECM 하이드로겔을 이용하여 담관(Bile duct) 오가노이드를 제작하였다. dECM 하이드로겔에서 배양된 오가노이드는 인간의 간 특이적 유전자 및 단백질을 발현하며 간 오가노이드로 성장하는 것을 확인하였다. 이 연구에서는 돼지의 간도 탈세포화하여 인간과 돼지의 dECM 차이를 확인하였다. dECM을 분해(Digestion)하는 과정에서 인간의 dECM이 돼지의 dECM보다 분해가 잘 되지 않았는데, 연구팀은 이것이 장기의 나이, 즉 노화 관련 ECM 단백질의 비효소적 교차결합(Cross-linking)의 정도 차이 때문일 것으로 예상했다. 그러나 인간과 돼지의 간 유래 dECM을 활용한 오가노이드 간에는 유의미한 차이가 관찰되지 않았다. 흥미로운 것은 마트리겔에는 라미닌이 풍부한데, 이러한 마트리겔에서 생산된 오가노이드에서는 더 많은 프로테오글리칸이 발견된 반면, 콜라겐이 풍부한 dECM을 통해 생산된 오가노이드에서는 더 많은 콜라겐이 발견되었다는 점이다. 이는 세포가 생산하는 단백질들이 배양 매트릭스에 영향을 받는다는 것을 시사한다.
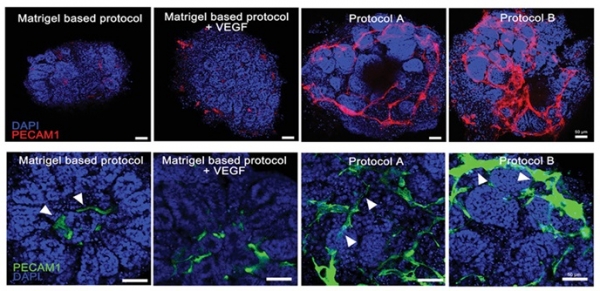
그림 2. 콩팥 오가노이드의 혈관(PECAM1) 발달에 영향을 미치는 dECM(Protocol A, B) [15].
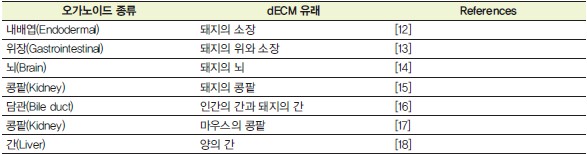
표 1. dECM유래 하이드로겔을 사용하여 제작한 오가노이드 [12-18]
3. 결론 및 토론
오가노이드 생성에 마트리겔을 대체할 물질을 찾는 연구들이 많이 이루어지고 있다. 조직 및 장기의 탈세포화를 통해 얻어지는 dECM을 활용한 하이드로겔은 생체와 유사하게 조직 특이적 단백질을 가진다는 장점을 가지고 있다. 조직 및 장기의 탈세포화를 위해서 크게 화학적, 물리적, 생물적(효소) 방법이 제시된다. 이러한 방법을 통해 세포가 제거된 조직에는 ECM 단백질만이 남게 되고, 조직 특이적 하이드로겔은 오가노이드 배양에 활용할 수 있다.
특히 이러한 dECM 하이드로겔은 오가노이드 생성에서 세포의 성장 및 분화에 영향을 줄 수 있는 기계적(Mechanical) 특성들을 탈세포화 프로토콜에 따라 조절할 수 있기 때문에 만들고자 하는 오가노이드에 따라 적합한 강성으로 조절이 가능하다는 장점이 있다 [19]. 하지만 이때 강성의 조절은 세포가 하이드로겔에 침투하는 능력 및 산소, 영양소, 노폐물의 확산에도 영향을 미칠 수 있으므로 다방면의 연구를 통해 적정 농도를 잡아야 한다.
dECM 하이드로겔을 이용한 오가노이드의 연구는 마트리겔의 대체물질을 찾는 것뿐 아니라 조직공학 및 장기모델링을 전략적으로 수행할 수 있는 중요한 기회가 될 수 있다. 다양한 장기의 dECM을 활용한 오가노이드 연구는 생체와 더 가까운 장기 유사체의 모사를 가능하게 함으로써 재생의학, 질병 모델링, 약물 개발 등에 실질적으로 활용할 수 있는 기반을 마련할 수 있을 것으로 기대된다.
참고문헌
1. McCrary, M. W., Vaughn, N. E., Hlavac, N. et al. (2020) Novel sodium deoxycholate-based chemical decellularization method for peripheral nerve. Tissue Eng Part C Methods 26(1), 23-36.
2. Shahraki, S., Bideskan, A. E., Aslzare, M. et al. (2022) Decellularization with triton X-100 provides a suitable model for human kidney bioengineering using human mesenchymal stem cells. Life Sci 295, 120167.
3. Qiu, X., Lee, B. L.-P., Wong, S. Y. et al. (2021) Cellular remodeling of fibrotic conduit as vascular graft. Biomaterials 268, 120565.
4. Poornejad, N., Schaumann, L. B., Buckmiller, E. M. et al. (2016) The impact of decellularization agents on renal tissue extracellular matrix. J Biomater Appl 31(4), 521-533.
5. Casali, D. M., Handleton, R. M., Shazly, T. et al. (2018) A novel supercritical CO2-based decellularization method for maintaining scaffold hydration and mechanical properties. J Supercrit Fluids 131, 72-81.
6. Kim, B.-S., Kim, J.-U., So, K.-H. et al. (2021) Supercritical fluid-based decellularization technologies for regenerative medicine applications. Macromol Biosci 21(8), 2100160.
7. Roth, S. P., Glauche, S. M., Plenge, A. et al. (2017) Automated freeze-thaw cycles for decellularization of tendon tissue - a pilot study. BMC Biotechnol 17(1), 13.
8. Carbonaro, D., Putame, G., Clotilde, C. et al. (2020) A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Med Eng Phys 85, 7-15.
9. Sano, M. B., Neal, R. E., Garcia, P. A. et al. (2010) Towards the creation of decellularized organ constructs using irreversible electroporation and active mechanical perfusion. BioMed Eng Online 9, 83.
10. Shin, Y. H., Park, S. Y. & Kim, J. K. (2019) Comparison of systematically combined detergent and nuclease-based decellularization methods for acellular nerve graft: An ex vivo characterization and in vivo evaluation. J Tissue Eng Regen Med 13(7), 1241-1252.
11. Rahman, S., Griffin, M., Naik, A. et al. (2018) Optimising the decellularization of human elastic cartilage with trypsin for future use in ear reconstruction. Sci Rep 8(1), 3097.
12. Giobbe, G. G., Crowley, C., Luni, C. et al. (2019) Extracellular matrix hydrogel derived from decellularized tissues enables endodermal organoid culture. Nat Commun 10(1), 5658.
13. Kim, S., Min, S., Choi, Y. S. et al. (2022) Tissue extracellular matrix hydrogels as alternatives to Matrigel for culturing gastrointestinal organoids. Nat Commun 13(1), 1692.
14. Simsa, R., Rothenbucher, T., Gurbuz, H. et al. (2021) Brain organoid formation on decellularized porcine brain ECM hydrogels. PLOS ONE 16(1), e0245685.
15. Kim, J. W., Nam, S. A., Yi, J. et al. (2022) Kidney decellularized extracellular matrix enhanced the vascularization and maturation of human kidney organoids. Adv Sci 9(15), 2103526.
16. Willemse, J., van Tienderen, G., van Hengel, E. et al. (2022) Hydrogels derived from decellularized liver tissue support the growth and differentiation of cholangiocyte organoids. Biomaterials 284, 121473.
17. Nag, S. & Boyd, A. S. (2023) Decellularization of mouse kidneys to generate an extracellular matrix gel for human induced pluripotent stem cell derived renal organoids. Organoids 2(1), 66-78.
18. Saheli, M., Sepantafar, M., Pournasr, B. et al. (2018) Three-dimensional liver-derived extracellular matrix hydrogel promotes liver organoids function. J Cell Biochem 119(6), 4320-4333.
19. Singelyn, J. M. & Christman, K. L. (2011) Modulation of material properties of a decellularized myocardial matrix scaffold. Macromol Biosci 11(6), 731-738.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
