| 만능줄기세포 기반 신장 오가노이드의 연구 동향 | |
|---|---|
| Date 2024-04-29 15:28:31 |
|

교수 / 석박통합과정 / 박사과정
중앙대학교 융합공학부
thkim0512@cau.ac.kr / sse0913@cau.ac.kr / rlackdeo4@cau.ac.kr
1. 서론
오가노이드 (organoid)란, 폐, 간, 심장, 신장, 소장, 피부 및 뇌 등을 포함하는 다양한 인간의 장기를 세포의 구성, 조직 구조 및 기능성 측면에서 인공적으로 모방하는 장기모사체이다. 현재 약물스크리닝 시 독성 및 효능 평가를 위해 광범위하게 활용되는 동물 실험은 종간 이질성으로 인한 높은 임상 실험 실패율과 함께 실험 동물에 대한 윤리적 문제 등으로 많은 문제에 직면해 있는 것이 사실이다. 오가노이드의 경우 구조적, 기능적으로 실제 장기와 유사한 생리적 특성을 나타내고 있어, 기존의 단순 세포를 기반으로 하는 체외 약물 스크리닝 기법의 낮은 약물 효능/독성 예측력과 동물 실험의 문제점을 동시에 해결할 수 있는 생물공학 분야에서 차세대 핵심 기술로 평가받고 있다.
2009년 Hans Clevers 박사 연구팀에서 최초로 crypt-villus 구조를 가지는 장 오가노이드를 보고한 이후, 유도만능줄기세포 (iPSCs)를 이용하여 뇌, 위, 신장, 폐, 간 등 여러 장기 유래의 오가노이드가 보고되었으며, 암 환자 조직을 기반으로 환자 개인의 특성이 유지된 암 오가노이드 배양또한 성공하였다 [1]. 이를 기반으로 안전성 평가, 효능 평가, 치료제 개발 등 다양한 부분에서 동물실험을 대체할 수 있는 기술로 각광 받고 있다.
그러나, 오가노이드 제작 방법은 기본적으로 생물체의 발생 과정을 모사하므로, 줄기세포의 분화 과정에서 저분자 물질 및 단백질을 포함한 최소 5종 이상의 분화유도인자가 특정 농도와 기간 동안 처리되어야 하는 등 그 제작 과정이 매우 복잡하다. 따라서 각 연구기관마다 프로토콜에 차이가 존재하며, 동일한 프로토콜을 기반으로 오가노이드 제작을 수행하더라도 실험실 간 미세환경의 차이에 의해 Batch-to-Batch 변동성이 높게 나타난다. 이처럼 오가노이드의 제작 과정에 따른 발생 양상이 다양한 실정이며, 제작이 끝난 오가노이드의 경우에도 그 성숙도와 기능성, 구조적 유사도 등을 평가하는 것에 대한 기준이 모호하여 실질적인 약물 스크리닝 활용을 위한 상용화 단계로의 진입에 어려움을 겪고 있다. 따라서, 오가노이드의 활용을 위해서는 대량화, 균질화, 재현성 확립을 위해 기능성 평가를 필수적으로 해결하여야 한다.
다양한 오가노이드 중 신장 오가노이드의 경우, 효과적인 혈액 여과를 위해 존재하는 신장 내에 반복적으로 나타나는 ‘네프론’의 복잡한 조직학적 특성 및 기능을 효과적으로 모사하여 약물 처리 시 오가노이드 내 세포의 거동 변화를 연구하기에 생리학적으로 적합한 모델로 평가받고 있다. 2014년 신장 오가노이드 관련 첫 논문이 게재된 이후로 신장에서 발생하는 신장염, 사구체신염 및 다낭성 신종(polycystic kidney disease), 파브리병(Fabry’s disease), 신증후군(nephrotic syndrome)과 같은 질병 유도 모델에 대한 유효성 모델이 연구되고 있다. 신장 오가노이드는 복잡한 사구체의 구조를 모사하는 것이 핵심적인 유효성 평가 지표로 여겨지지만, 현행 프로토콜 상 오가노이드 내 혈관 형성이 제한적이고 off-target 세포들이 존재하여 실제 임상 치료 및 산업 현장에 적용하기 위해서는 제작된 신장 오가노이드에 대한 안전성 및 품질 평가가 되어야 하고, 신장을 구성하는 세포 이외의 다른 조직 세포로 분화한 세포를 정확히 탐지할 수 있어야 하며, 신장 오가노이드의 기능성/활성을 고효율로 분석 및 품질 평가를 하여 약물 평가도 함께 진행되어야 한다.
본 기고에서는 현재까지 보고된 만능줄기세포 기반 신장 오가노이드의 국내/외 연구 동향과 신장 오가노이드의 성숙도 평가기술에 대한 최신 연구동향에 대해 살펴보고자 한다.
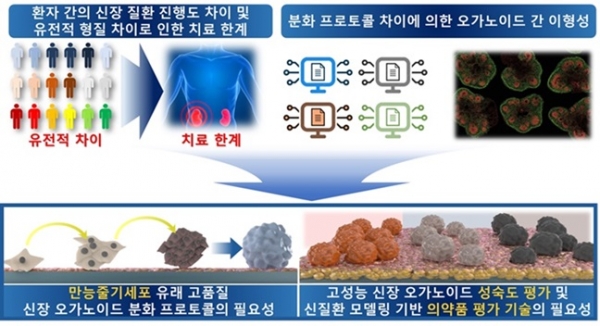
그림 1. 고도화된 줄기세포 유래 신장 오가노이드 제작 및 평가기술의 필요성.
2. 신장 오가노이드 연구 동향
신장 오가노이드를 포함한 다양한 오가노이드의 경우, 크게 primary cell culture를 통한 세포 취득 후 이의 체외 배양으로 제작하는 방법과 배아줄기세포 및 유도만능줄기세포를 포함하는 만능줄기세포의 분화를 통해 취득하는 방법이 있다. 그러나 신장의 경우 대상 장기로부터 다량의 세포 또는 성체줄기세포를 취득하는 것이 불가능하므로 현재까지 대부분의 연구는 유도만능줄기세포 (iPSC, induced pluripotent stem cell) 또는 배아줄기세포 (ESC, embryonic stem cell)를 기반으로 제작하는 방법이 주를 이루고 있다.
현재까지 Melissa Little 연구팀, Ryuichi Nishinakamura 연구팀을 필두로 iPSC 기반 신장 오가노이드 프로토콜의 확립 및 개선을 이루어 나가고 있으며, 신장의 발달이나 발생 메커니즘을 이해하고자 하는 시도 외에도, 질병 모델링 및 의약품 등의 안전성/유효성 평가 및 신장 오가노이드의 체내 이식 등 다양한 연구들에 대한 소개를 소개하고자 한다 [2,3].

그림 2. 신장 오가노이드의 기술 고도화 및 성숙도 평가를 위한 기술 동향.
2.1. 분화 프로토콜의 고도화
일반적인 신장 오가노이드 배양 프로토콜의 경우, 사구체의 형태학적 모사를 핵심 지표로 삼아 분화를 진행하는 것이 일반적이지만, 보다 정확한 신질환 및 신독성 스크리닝 평가를 위해서는 고도화된 신장 오가노이드를 생산하는 것이 중요하다.
하지만, 대부분의 신장 오가노이드의 경우 체내의 복잡하고도 성숙한 네프론의 구조를 모사하기는 불가능에 가까운 실정이며, 현재까지는 전분화능 줄기세포를 기반으로 초창기 태아의 세포 구성 및 기능적 부분만 모사하는 실정이다.
Mooney group에서는, 세포외기질(ECM, extracellular matrix)의 3차원 encapsulation을 통한 물리적 특성을 조절하여 신장 형성과정을 조절하고자 하였다. 오가노이드 배양에 주로 사용되는 Matrigel 등을 사용한 하이드로겔은, 점탄성 및 강성 등의 물리적 특성을 조절하기 어려울 뿐만 아니라 batch 간 차이가 크므로, 알지네이트를 활용하여 물리적 특성이 조절된 하이드로겔을 형성하여 신장 오가노이드의 분화 정도를 확인하였을 때, 점탄성도에 따른 신장형성의 특성이 조절됨을 확인하여 2024년에 보고한 바 있다 [4]. 국내의 경우, 돼지의 신장을 탈세포화한 후, ECM 추출 및 혈관 신생에 주요한 역할을 하는 TGF-β 신호의 조절, VEGF 성장인자를 정교하게 혼합하여 혈관 내피세포 증식이 항진되어 오가노이드 내 혈관망이 형성된 신장 오가노이드 고도분화 프로토콜을 개발한 바 있다 [5]. 신장의 복잡한 구조 및 기능을 모사하는 것은 네프론 형성뿐만 아니라 집합관 및 내부 혈관 형성 등의 성숙도 조절이 핵심 인자이다. 특히, 근위세뇨관(proximal tubule)은 신장의 재흡수 기능을 담당하는 부분으로, 현행 프로토콜 상에서는 성숙도가 낮아 네프론의 기능성 및 약물에 대한 재흡수를 정확히 모사하기 어려운 실정이다.
Little 연구진에서는, air–liquid interface 상에서 PSC에서의 분화 유도 시, 3차원 오가노이드 배양 전단계인 monolayer 배양 단계를 13일 동안 연장하여 진행함으로써 proximalized nephron의 길어지게 되고, 성숙한 proximal tubule 형성을 2023년 보고하였다 [2].
2.2. 신장 질환 모델링을 통한 약물 평가
CRISPR-Cas9 유전자 편집기술이 개발된 이후, 유전적 돌연변이에 의해 발생되는 신질환 모델링 연구가 활발히 진행되고 있다.
다낭성 신종 (PKD,polycystic kidney disease)은 양쪽 신장에 다수의 낭종이 발생하여 고혈압과 신장 기능 저하가 생기는 질환으로, PKD1과 PKD2 유전자의 돌연변이가 대부분 발생하는 것으로 알려져 있다. McMahon group에서는 CRISPR-Cas9 기술을 통하여 해당 유전자를 비활성화시킨 신장 오가노이드를 구현하였고, 해당 모델에서 낭종이 형성되며 장기 배양 시 센티미터 단위로 성장하는 것을 확인하였으며, 이를 기반으로 247가지의 protein kinase inhibitors(PKIs)를 스크리닝하였고 오가노이드의 성장은 저해하지 않으면서 낭종을 선택적으로 억제하는 물질 발굴에 성공한 결과를 2022년 보고한 바 있다 [6].
유사하게, NPHS1 돌연변이에 의해 주로 발생되는 선천성 신증후군(Congenital nephrotic syndrome) 및 파브리병(Fabry’s disease) 등의 질환도 유전자 편집기술을 통한 모델링 및 약물 스크리닝 기술이 보고된 바 있다 [7,8].
그럼에도, 대부분 전분화능 줄기세포 유래 신장 오가노이드를 기반으로 유전자 편집 및 약물 효능 평가를 진행하게 되는데 이는 신장의 기능을 완전히 모사하기에는 부족하므로, 실제 환자의 소변 및 신장 조직에서 유래하여 연구에 접목하는 tubuloids의 개념을 2019년 Clevers group에서 보고한 뒤, 다양한 신질환 모델링을 위한 tubuloids가 진행되고 있다 [9]. 그중에서도, 상염색체 우성 다낭신장병을 모델링하기 위해, Kramann group에서는 신장 상피세포를 활용해 해당질병을 모사하였으며, 유일하게 FDA에 허가를 받은 약물인 tolvaptan을 전분화능 줄기세포를 기반으로 제작된 신장 오가노이드와 효능을 비교하였을 때, tubuloids에서만 유의미한 낭종 크기의 감소를 나타내었다 [10].
2.3. 신장 오가노이드 이식 기반 연구
최근, 신장 오가노이드를 기반으로 발달 과정 혹은 질병 모델링에 활용하는 것을 넘어서, 신장 오가노이드를 체내 이식하여 약물동역학적 평가 혹은 혈관 신생 등의 효과가 나타남이 보고된 바 있다. 대표적으로 Rabelink 연구팀에서는 혈관이 구축되지 않은 유도만능줄기세포 기반 신장 오가노이드를 배양한 후, chicken embryo에 주입하였을 때 오가노이드 내 혈관 생성이 촉진되는 것뿐만 아니라 관 세포 및 기질 세포의 성숙도가 증가하는 것을 밝힌 바 있다 [11]. 또한, 신장 질환 표적 치료제의 발굴을 위한 약물동역학적 연구에는 일반적으로 쥐 모델을 통한 효능 평가를 확인하게 되는데, 인간과 쥐의 신독성에 대한 반응이 상이하므로 이를 극복하기 위한 새로운 모델로써, 인간 유래 신장 오가노이드를 동물에 이식하는 새로운 접근법이 Mundel group에 의해 보고된 바 있다 [12]. 흉선이 제거된 쥐모델에 오가노이드를 이식한 후 GFP-887을 투여하였을 때, 오가노이드에 약물이 노출됨을 확인하였으며 약물농도구배에 따른 신장 오가노이드의 보호 반응이 일어남을 확인한 바 있다. 이를 통해 약물동역학적 연구에서 인간 유래 오가노이드의 이식을 통한 다양한 신약 개발 연구가 가능성을 보고하였다.
3. 신장 오가노이드의 성숙도 및 기능 평가 기술
신장 오가노이드를 기반으로 질병의 기전 연구 및 신약 개발 등의 다양한 활용 분야에 적용됨에 따라, 고품질의 오가노이드를 제작하고 이를 평가하는 새로운 평가 기술이 더욱 중요해지는 상황이다. 현재까지 제작된 오가노이드를 검증하기 위해서는 장기 특이적 단백질의 발현 혹은 효소의 활성을 시험하여 특정 장기로의 분화 정도와 기능에 대하여 정성적으로 분석하였다. 하지만, 신장 오가노이드의 경우 고품질의 오가노이드를 정량적으로 평가할 만한 표준 지표가 없으며, 조직 특이적 마커를 통한 확인의 경우 세포의 분해 및 해리 등 파괴적 과정을 필수적으로 거쳐야하기 때문에 오가노이드의 지속적인 관찰이 불가능하다. 따라서, 제작된 신장 오가노이드의 성숙도 및 분화도 확인을 위한 효율적이고 새로운 개념의 평가기술이 보고되고 있다.
3.1. 알고리즘 기반 신장 오가노이드의 표준화 및 분류 기술
오가노이드의 조직학적 발생 및 분화에 따른 이질성 등을 분석하기 위한 방법으로, single-cell RNA-sequencing 방식을 통해 신장 오가노이드 내 25종 이상의 세포 유형을 single-cell 단위로 분류가 가능해졌지만, 방식이 어려울 뿐만 아니라 각 기관마다의 분화 프로토콜이 상이해 표준화된 데이터를 얻는 것이 제한된다. 이를 극복하기 위해, Little group에서는 R 프로그램을 기반으로 하여 dataset이 보고된 13개의 신장 오가노이드 분화 프로토콜을 프로그램화하여 (DevKidCC) 줄기세포 유래 신장 오가노이드 뿐만 아니라 인간 조직 유래 신장 오가노이드도 구분 가능하며, 성숙도 평가가 가능한 서비스를 제공하고 있다 [13].
또한, 이승철 교수 연구팀은 분화가 완료된 300개 이상의 신장 오가노이드를 딥 러닝 영상 분석을 기반으로 신장 족세포, 세뇨관 상피세포, 내피 세포의 유전자 발현 정도를 학습하여 영상만으로 유전자 발현을 예측할 수 있는 시스템 구축에 성공함을 2023년에 보고한 바 있다 [14].
3.2. 광학 기반 신장 오가노이드의 기능 평가 기술
신장의 기본적인 기능 중 하나인 사구체에서의 여과과정은 모세혈관과 족세포 (podocytes)와의 상호작용으로 체와 같은 역할을 수행하게 된다. 이식된 신장 오가노이드의 체내 여과 기능을 평가하기 위해, 혈장과 소변에서 분비 및 재흡수되지 않는 dextran을 주입 후 이를 고성능 생체현미경을 기반으로 여과기능의 측정 및 평가가 가능함을 Rabelink 연구팀에서 보고한 바 있다 [15]. 또한, 신증후군 (nephrotic syndrome)의 경우 유전적 변형에 의한 족세포의 세포질 내 칼슘 농도의 증가로 인한 사구체 여과 장벽의 파괴가 발생하게 된다. 하지만, 칼슘 신호체계의 역할이 초기 여과장벽의 형성 시 어떠한 영향을 미치는지 확실히 밝혀진 바가 없었는데, 현미경 기반 칼슘 이미징 기술을 신장 오가노이드에 접목하여 칼슘 신호경로의 영향을 분석 및 이를 성숙도의 지표로 사용 가능함을 보고하였다 [16].
3.3. 전기화학적 신호 기반 신장 오가노이드의 성숙도 평가 기술
본 연구팀은 전도성 투명물질 기반 금 나노 구조체의 전기화학적인 증착법을 통해 세포를 배양 및 세포 특이적인 전기적 신호를 검출할 수 있는 세포칩을 2010년 처음 개발하였다. 이를 기반으로 세포 특이적인 전기화학 신호를 통해 세포의 활성도 및 약물에 대한 효능 평가하는 것에 성공하였다. 이는 미토콘드리아 내 대사 과정에서 ATP가 형성될 때 발생 하는 산화·환원 (Redox) 반응들이 신호에 영향을 주는 인자임을 확인하였다. 이를 기반으로 유도만능줄기세포 유래 신장 오가노이드로의 분화를 유도하였으며 오가노이드의 형성 과정을 비표지/비파괴 방식으로 탐지 및 성숙도 평가가 가능함을 2022년에 보고하였다 [17]. 특히, 신장 오가노이드의 분화 성숙도에 따라 전기화학적 신호 검출의 전위 및 검출 세기가 변화하므로 이를 정량화 및 성숙도 평가를 위한 표준화 지표로의 가능성을 선보인 바 있다.
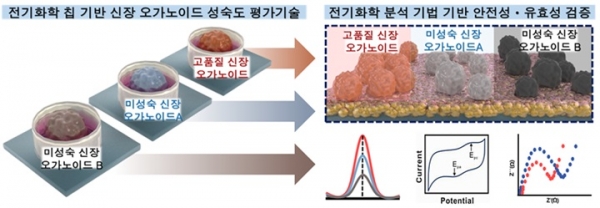
그림 3. 전기화학 기반 신장 오가노이드 성숙도 평가 플랫폼.
4. 맺음말
오가노이드 모델의 발달과 활발한 연구에도 불구하고, 품질 관리 측면에서 국제적으로 통용되는 기준이 전무하며, 그중에서도 가장 복잡한 구조를 형성하는 신장 오가노이드의 경우 분화 성공률이 타 장기 오가노이드 대비 낮고, 성숙도에 대한 지표가 제한적이므로 현재 신장 오가노이드의 상업적 활용은 제한적인 것이 사실이다. 하지만, 만성 신장병 환자의 증가 및 동물실험을 대체할 수 있는 기술로서 신장 오가노이드를 이용한 재생치료제 등의 수요가 계속적으로 증가할 것으로 전망되며 이를 위해 신장 오가노이드 이식, 타 장기와의 연결 등의 바이오 R&D 개발을 위해 정부 차원에서의 핵심 인재 육성 및 융합 연구 등 적극적인 지원을 추진하고 있다. 이러한 노력으로, 국내에서 개발된 원천기술로 고성능/고효율 신장 오가노이드의 분화 프로토콜 및 배양 배지 최적화, 성숙도 평가를 위한 정량적 분석 기술을 통한 표준화 기술 선제적 점유 등의 연구를 통하여 개발 초기 단계인 신장 오가노이드의 시장 점유율을 차지할 수 있을 것으로 기대된다.
참고문헌
1. Sato, T., Vries, R., Snippert, H. et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459, 262–265 (2009).
2. Vanslambrouck, J.M., Tan, K.S., Mah, S. et al. Generation of proximal tubule-enhanced kidney organoids from human pluripotent stem cells. Nat. Protoc 18, 3229–3252 (2023).
3. Tanigawa, S., Tanaka, E., Miike, K. et al. Generation of the organotypic kidney structure by integrating pluripotent stem cell-derived renal stroma. Nat. Commun 13, 611 (2022).
4. Nerger, Bryan A., et al. 3D Hydrogel Encapsulation Regulates Nephrogenesis in Kidney Organoids. Adv. Mater, 2308325 (2024).
5. Kim, Jin Won, et al. Kidney decellularized extracellular matrix enhanced the vascularization and maturation of human kidney organoids. Adv. Sci 9.15,2103526 (2022).
6. Tran, Tracy, et al. A scalable organoid model of human autosomal dominant polycystic kidney disease for disease mechanism and drug discovery. Cell Stem Cell 29.7,1083-1101 (2022).
7. Kim, Jin Won, et al. Human kidney organoids reveal the role of glutathione in Fabry disease. Exp Mol Med 53.10,1580-1591 (2021).
8. Jansen, Jitske, et al. Human pluripotent stem cell-derived kidney organoids for personalized congenital and idiopathic nephrotic syndrome modeling. Development 149.9,dev200198 (2022).
9. Schutgens, F., Rookmaaker, M.B., Margaritis, T. et al. Tubuloids derived from human adult kidney and urine for personalized disease modeling. Nat. Biotechnol 37, 303–313 (2019).
10. Xu, Y., Kuppe, C., Perales-Patón, J. et al. Adult human kidney organoids originate from CD24+ cells and represent an advanced model for adult polycystic kidney disease. Nat. Genet 54, 1690–1701 (2022).
11. Koning, M., Dumas, S.J., Avramut, M.C. et al. Vasculogenesis in kidney organoids upon transplantation. npj Regen. Med. 7, 40 (2022).
12. Westerling-Bui, Amy D., et al. Transplanted organoids empower human preclinical assessment of drug candidate for the clinic. Sci. Adv 8.27,eabj5633 (2022).
13. Wilson, S.B., Howden, S.E., Vanslambrouck, J.M. et al. DevKidCC allows for robust classification and direct comparisons of kidney organoid datasets. Genome Med. 14, 19 (2022).
14. Park, Keonhyeok, et al. Deep learning predicts the differentiation of kidney organoids derived from human induced pluripotent stem cells. Kidney Res Clin Pract. 42.1,75 (2023).
15. Van Den Berg, Cathelijne W., et al. In vivo assessment of size-selective glomerular sieving in transplanted human induced pluripotent stem cell–derived kidney organoids. JASN 31.5,921 (2020).
16. Djenoune, Lydia, et al. Autonomous calcium signaling in human and zebrafish podocytes controls kidney filtration barrier morphogenesis. JASN 32.7,1697 (2021).
17. Suhito, Intan Rosalina, et al. In situ detection of kidney organoid generation from stem cells using a simple electrochemical method. Adv. Sci 9.20, 2200074 (2022).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update 
