| 링커기술을 중심으로 한 항체-약물 복합체 기술 개요 | |
|---|---|
| Date 2023-10-13 01:10:49 |
|

교수
성균관대학교 약학대학
sjchung@skku.edu
1. 항체-약물복합체(ADC)의 역사와 개념
항체-약물복합체(Antibody-drug Conjugate, ADC)는 강력한 세포독성 항암제를 암세포 특이적인 항체에 접합하여 암세포 내부로 전달함으로써 정상세포 보다는 암세포에 선택적인 독성을 나타내도록 제작된 표적항암제의 일종이다. 표적항암제는 1906년 독일 과학자였던 Paul Erich 박사가 제안한 “마법의 탄환(magic bullet)”이라는 개념으로 부터 시작되었다. 1958년과 1967년 항체에 저분자약물을 접합시킨 약물이 개발되었으며 1975년에 동물시험을 진행하였으나, 다중클론 동물항체를 사용한 것이어서 장기간 투여를 요하는 만성질환의 치료제와는 거리가 멀었다. 1975년에 하이브리도마 기술 개발로 단일클론 항체기술이 개발되었고 1988년 인간화 항체가 개발되면서 항체치료제와 ADC 치료제 개발의 길이 열렸다. 2000년에 화이자와 와이어스에서 최초의 ADC 치료제인 Mylotarg에 대하여 미국 FDA로부터 신약승인을 받았으나 2010년 시장에서 철수하는 고난을 겪었다. 2010년 씨젠과 다케다 제약에서 개발한 혈액암 치료용 ADC인 Adcetris가 최초로 미국 FDA로부터 신약승인을 받고 시판됨으로써 Ehrlich 박사가 제안한 마법의 탄환이 100년이 지난 시점에 의약품으로 시장에 출시되게 되었다 (그림 1).
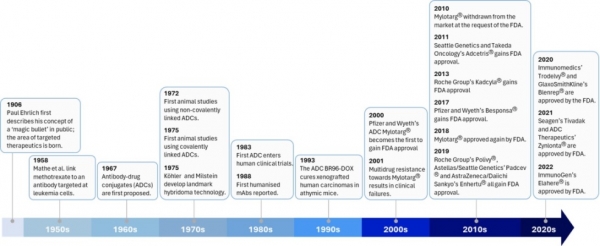
그림 1. ADC 개발사. 참고자료 [1]로부터 그림을 수정·보완하였음.
항체의약품은 환자의 면역기능에 의존하여 치료효과를 나타내게 된다. 그러나 면역기능이 저하되거나 항원 발현이 저조한 암환자에게는 항체의약품을 투여하여도 우수한 치료효과를 기대하기 어려운 경우가 있다. 저분자 항암제의 경우 수동확산에 의하여 세포 침투가 가능하기 때문에 정상세포와 암세포를 구분하지 못하여 독성을 유발하게 된다. ADC는 구조적으로 항체와 페이로드(세포독성 약물), 그리고 두 가지 요소를 연결해 주는 링커로 구성되어 있다. ADC는 세포독성이 강한 페이로드와 표적지향성이 높은 항체를 접합하여 페이로드가 정상세포로 유입되는 것을 최소화함으로써 독성을 줄이고, 약물이 혈관에 갇히어 전신분포를 감소시킴으로써 약물의 혈관 내 유효농도를 높여 약효를 증진시키는 효과가 있다. 또한, 항체의 높은 분자량으로 인하여 신사구체 통과가 불가하여 오랫동안 몸 안에 머물기 때문에 결과적으로 세포 독성 항암제의 생물학적 반감기를 늘려주는 역할을 한다. 정상조직에 비하여 종양조직은 혈관이 느슨하여 고분자인 항체가 잘 투과할 수 있으므로 세포독성 항암제인 페이로드 측면에서 생각하면 소량의 페이로드를 ADC 형태로 투여할 경우 오랫동안 혈관에 머물며 지속적으로 종양조직에 약물을 공급하게 된다. 따라서 ADC는 약효지속형 표적항암제라고 정의할 수 있다.
ADC에 접합된 페이로드는 항체의 높은 분자량으로 인하여 수동확산에 의한 세포침입이 불가능하므로 세포 내에 있는 표적 단백질이나 DNA에 다가갈 수 없다. 즉, ADC의 일부로 존재하는 페이로드는 약효도 없고 독성도 없다. ADC를 구성하는 항체는 암세포에 과발현되는 항원을 인식하여 항원-항체 복합체를 형성한 후 엔도사이토시스(endocytosis) 과정을 거쳐 세포 안으로 침투한다. 이어서 리소좀(lysosome)과 융합된 후 리소좀 내에 과발현된 단백질 가수분해 효소에 의하여 항체가 분해되면 페이로드가 세포질이나 핵 안으로 이동하여 표적단백질이나 DNA를 공격함으로써 항암효과를 나타내게 된다. 이때 암세포는 주로 세포자멸사(apoptosis) 과정을 거쳐 사멸하며, 페이로드는 해당 암세포에서 밖으로 방출되어 인접한 다른 암세포를 공격하게 된다. 이 같은 현상을 “By-stander effect”라고 부른다 (그림 2). By-stander effect는 유전형이 다른 세포로 구성된 고형암 치료에 매우 중요한 역할을 한다. 즉, 일반 항체치료제의 경우 동일 종양조직을 구성하는 암세포라도 항원발현이 매우 낮거나 없는 경우에는 항암효과를 주기 어렵다. ADC는 일종의 전구약물(Prodrug)로써 표적 암세포에 의하여 활성화된 페이로드가 종양조직에 농축되고 수동확산을 통하여 항원이 없는 암세포에도 침투하여 항암효과를 나타낼 수 있다.
ADC는 저분자 항암제와 항체의약품의 장점을 최대한 활용한 약물로 최근 글로벌 제약사에서 많은 투자가 진행되고 있고 국내에서도 대기업을 중심으로 ADC 위탁개발생산(CDMO) 사업에 많은 관심을 보이고 있다. 또한 많은 중견제약사에서도 ADC 신약개발에 많은 관심을 보이고 있다. 이번 글에서는 ADC 기술에 관하여 기술하고 현재 임상 승인을 받은 ADC를 소개하고자 한다.
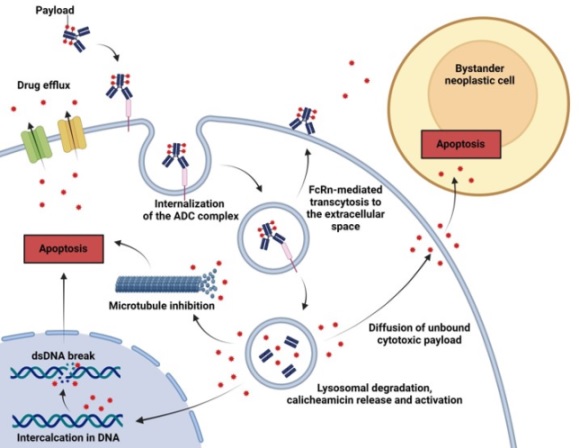
그림 2. ADC의 항암작용기전. ADC가 암세포 특이적인 항원을 인식하고 엔도사이토시스 과정을 거쳐 암세포 안으로 침투한 후 리소좀에 과발현된 단백질 분해효소에 의하여 항체가 분해된 후 페이로드가 세포질이나 핵 안으로 이동하여 항암효과를 나타내게 된다. 이후 페이로드는 사멸된 암세포 밖으로 유출되어 인접한 암세포를 공격하게 된다. (참고문헌 [2]의 그림을 변형하였음)
2. 항체-약물복합체(ADC)의 요소기술
항체-약물복합체의 요소기술은 항체, 페이로드, 그리고 두 가지를 연결하는 링커 기술로 요약될 수 있다. ADC용 항체는 일반 항암항체와 다른 특성을 가진다. 일반 항암항체는 암세포 표면에 과발현되는 항원을 인식하여 결합하고 오래도록 세포 표면에 머물면서 면역세포와 면역보체를 암세포 주변으로 유인함으로써 면역시스템이 암세포를 공격하여 항암효과를 나타낸다. 반면에 ADC용 항체는 암세포 표면에 과발현되는 항원을 인식하여 결합한 후 엔도사이토시스를 통하여 암세포 안으로 내재화되는 특징을 가져야 한다. 항원-항체 복합체의 내재화 능력은 항체 뿐 아니라 항원의 고유한 특성에도 의존하기 때문에 모든 항암항체가 ADC 제작에 활용될 수 있는 것은 아니다. 즉 ADC의 표적이 될 수 있는 항원을 찾아내는 것이 선행되고 그 후에 내재화 능력이 뛰어난 항체를 발굴하여야 한다.
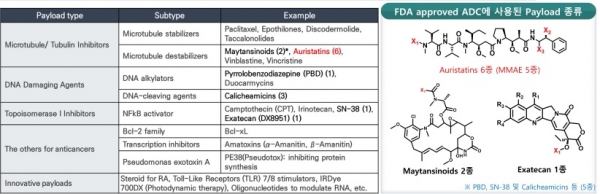
일반적으로 저분자 약물은 수동확산에 의하여 세포 안으로 침투가 용이하므로 농도 의존적으로 약물이 세포에 침투할 수 있다. 그러나 ADC는 항원을 매개로 하여 세포 안으로 침투하기 때문에 암세포 표면의 항원 농도가 높지 않거나 혹은 엔도사이토시스를 통하여 항원이 고갈되고 나면 더 이상 약물이 침투할 수 없다. 즉, 저분자 항암제에 비하여 ADC는 적은 수의 약물을 암세포로 전달할 수밖에 없다. 따라서 ADC용 페이로드는 대부분 매우 강력한 세포독성을 가진 약물이 사용된다. ADC에 사용되는 페이로드는 미세소관 억제제(maytansinoid, MMAE 등), DNA 손상 약물(PDB, Duocarmycin, Calicheamycin 등), DNA 토포이소머라제 억제제(SN-38, Deruxtecan (Dxd) 등) 등이 대표적이며 in vitro 항암활성이 pM ~ nM 수준으로 독성이 매우 강한 약물 들이다.
ADC의 약효와 부작용은 대부분 페이로드에 의하여 좌우되므로 많은 경우 약리작용기작(Mode of action)과 독성에 관한 광범위한 연구가 진행된 약물이 페이로드로 선택된다. 가장 최근에 ADC 페이로드로 사용되어 큰 성공을 거둔 Deruxtecan (Dxd)의 경우 다이이치산쿄라는 일본 제약사가 Exatecan 이라는 이름으로 15건의 항암 임상을 진행한 끝에 개발을 포기한 약물이었다. 이 약물의 구조를 약간 변형하여 탄생한 Deruxtecan (Dxd)을 ADC 페이로드로 사용하여 개발된 엔허투(Enhertu)라는 ADC 약물은 그 항암효력이 매우 뛰어나고 독성이 적어 매우 우수한 항암제로 신약승인을 받았다. 그 후에도 동일한 페이로드를 이용하여 추가 ADC 항암제를 개발한 다이이치산쿄는 129억 불의 기술료를 받고 두 약물을 아스트라제네카에 권리이전(license-out) 하였다.
표 1. ADC에 빈번하게 사용되는 페이로드의 종류와 특성
3. 항체-약물복합체(ADC) 링커기술
항체-약물복합체 기술 중 가장 복잡한 부분이 링커기술이다. 최근 ADC 전반에 관한 총설들이 많이 발표되고 있다. 따라서 이 글에서는 세계적으로 경쟁이 치열한 ADC 링커기술에 대하여 자세히 소개하고자 한다. 전술하였듯이 페이로드가 항체에 접합되어 있을 때에는 약물동력학적 특성이 완전히 항체에 의존하며 약리활성을 나타내지 못하다가 항체로부터 이탈될 때 비로소 표적단백질이나 DNA에 결합이 자유로워지며, by-stander 효과도 나타낼 수 있다. 따라서 페이로드가 항체로부터 이탈하는 시간과 장소가 ADC 약물의 약효와 독성에 결정적인 영향을 줄 수 있다. 페이로드와 항체를 연결하는 부위가 링커이며 링커의 특성에 따라 ADC 약물의 제조방법, 안정성, 약효와 독성이 영향을 받는다. ADC 링커는 그 기능에 따라 크게 두 부위로 나누어 볼 수 있다. 먼저 1,300개 이상의 아미노산으로 구성된 복잡한 항체의 어떤 아미노산에 약물을 도입하고 항체 한 분자 당 몇 개의 약물을 도입할 것인가를 결정하는 항체접합링커와 어떤 환경에서 약물을 결정할 것인가를 결정하는 약물방출링커 혹은 트리거(trigger)라 부르는 부위가 있다 (그림 3).
그림 3. ADC 링커의 구성과 역할. ADC 링커는 항체접합링커(Antibody-conjugation linker)와 페이로드 방출링커(Payloadreleasing linker) 혹은 트리거(Trigger)로 구성되어 있다 [3].
약물이 항체에 접합되는 위치와 접합화학의 종류에 따라 ADC의 화학·생물학적 안정성이 크게 영향을 받게 되며 이는 곧 약물의 약물동력학적(Pharmacokinetic, PK) 특징에 직접적인 영향을 미치게 된다. 초기에 개발된 ADC는 항체에 존재하는 라이신이나 시스테인의 반응성을 이용하여 활성에스테르(active ester)나 말레이미드(maleimide) 같은 화학기능단을 가진 약물을 항체와 반응시켜서 제작되었다. 그러나 인간 IgG1 항체 한 분자에는 약 90개 정도의 라이신과 32개의 시스테인이 포함되어있으므로 이와 같은 화학반응은 필연적으로 복잡한 혼합물을 산출하게 된다. 혼합물을 구성하는 각각의 약물은 생체내 안정성에 큰 차이를 발생시킬 수 있다. 예를 들어 시스테인에 말레이미드를 반응시켜서 제작된 ADC의 경우 황원자의 산화에 따른 제거반응을 통하여 페이로드가 항체로부터 떨어져 나가 ADC의 약효를 감소시키거나 독성을 유발할 수 있다는 것이 잘 알려져 있다. 또한, 시스테인의 용매노출 정도에 따라 각 ADC 분자의 안정성이 다르므로 약효와 독성이 동일하지 않다. 이와 같은 문제를 해결하기 위하여 항체분자에 위치-특이적인 돌연변이를 유도하여 생성된 아미노산을 이용하여 위치-특이적으로 약물을 접합하는 항체접합 기술이 개발되었다. 이와 같은 링커를 위치-특이적 항체 접합 링커 (Site-specific antibody conjugation linker)라고 부른다. 미국 바이오테크 기업인 제넨텍에서 처음으로 이 기술을 개발한 이후에 많은 기업과 대학연구실에서 유사한 기술이 개발되었으며 국내에는 레고켐바이오와 알테오젠 등이 이 기술을 보유하고 있다(그림 4).
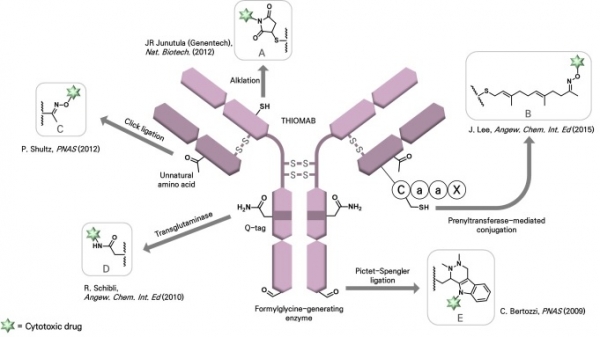
그림 4. 위치-특이적 항체접합 링커[4-8]. 그림은 참고문헌 8에서 수정하였음.
위치-특이적 항체접합링커의 개발로 구조가 분명한 ADC 제작이 가능하게 되었고 약물의 물리·화학적 특성을 조절할 수 있는 길이 열렸으나 이미 생산되어 판매되고 있는 기성항체(off-the-shelf antibody)나 많은 항체 개발자들이 가지고 있는 자연항체와 항체생산 세포주 등을 그대로 사용할 수 없다는 것은 이 기술의 단점으로 작용하였다. 일반적인 항체기업이나 연구소에서 개발한 항체가 ADC 제작에 적합하다고 판단될 경우 ADC 제작을 위하여 이 항체에 돌연변이를 유도하고 대량생산용 세포주를 개발하는 등 추가적인 연구개발이 선행되어야 함으로 부가적인 시간과 비용이 발생한다. 이는 개발속도가 중요한 글로벌 신약개발 경쟁에서 매우 불리한 요소로 작용할 것이다.
최근 이러한 문제점을 극복하고 기성항체를 그대로 사용할 수 있는 차세대 항체접합링커가 개발되어 ADC 제작에 활용되고 있다. 기술적 측면에서 보았을 때, 이 링커기술은 크게 두 가지로 분류될 수 있다. 첫째는 항체의 특정부위에 친화력을 가진 펩타이드 혹은 단백질 등을 활용하여 특정위치에 있는 아미노산에 선택적으로 화학기능단을 도입하고 이 기능단을 이용하여 약물을 접합하는 기술이다. 이를 친화력 기반 위치-선택적 링커(Affinity-based site-selective antibody conjugation linker)라고 부르며, 한국기업인 앱티스(주)가 개발하고 보유 중인 앱클릭(AbClickTM)과 일본기업인 아지노모토사가 개발한 아지캡(AJICAPTM)이라는 기술이 대표적이다 [9,10]. 앱클릭과 아지캡은 항체의 Fc-부위에 선택적으로 결합하는 펩타이드 리간드에 활성에스테르 기능단이 도입된 구조이다. 이 링커들이 항체의 Fc-부위에 가역적으로 결합하면 활성 에스테르가 특정 라이신(Lys248)의 일차아민 기능단 근처에 위치하여 선택적 반응을 통하여 아마이드 결합을 형성하게 된다. 두 링커는 비슷하지만 서로 다른 형태의 화학반응을 진행하여 IgG1의 Lys248에 클릭기능단을 도입한다. 이후에는 클릭반응을 통하여 항체에 약물접합이 진행된다 (그림 5). 앱클릭은 앱티스와 론자의 파트너십을 통하여 론자에서 ADC CDMO 서비스에 사용할 준비가 완료되었으며, 아지캡은 아지노모토가 운영 중인 CDMO 서비스를 통하여 상용화될 것으로 기대된다. 두 번째 링커기술은 당분해효소나 당전달효소를 이용하는 것이다. 시나픽스(Synaffix)라는 네덜란드 소재 기업은 항체의 당쇄를 절단하는 효소를 이용하여 당쇄의 일부를 제거한 후 다시 당전달 효소를 이용하여 남아있는 당쇄에 클릭기능단을 도입하는 기술인 GlycoConnectTM라는 기술을 개발하였다 [11]. 최근 이 기업은 세계 최대의 의약품 CDMO기업인 스위스 론자에 합병되었다. 스위스 소재 아라리스 바이오테크(Araris Biotech)는 당쇄의 절단 없이 직접 IgG1 Q295에 클릭 기능단을 전달하는 기술을 개발하였다 (그림 5). 그러나 이 기술은 특허등록은 되었으나 아직 논문을 통한 발표가 되지는 않고 있다 [12].
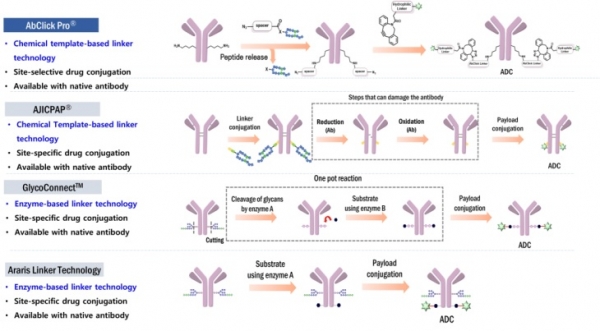
그림 5. 기성항체(Off-the-Shelf antibody)를 그대로 사용하여 ADC를 제작하는 항체접합링커 [9-12].
항체접합 링커는 약물의 체내 안정성에 큰 영향을 미침으로써, PK특성, 약효, 부작용에까지 영향을 미치게 된다. 2022년 Colombo 등은 페이로드와 임상에 사용 중인 해당 ADC의 MED와 MTD를 조사·비교한 결과 ADC에서 MED는 감소하였으나, 또렷한 MTD 증가가 없다고 보고하여 많은 ADC 연구자들을 당황하게 만들었다 [13]. 그러나 다음 해인 2023년 Gerber 등은 Colombo가 사용한 분석모델에 문제가 있음을 밝히고 나아가 링커의 종류가 MTD에 영향을 미친다는 것을 발표하였다 [14]. 저자들의 주장에 의하면 제1세대 링커의 경우 ADC 약물이 표적에 도착하기 전에 약물이 ADC에서 유리되면서 비표적 독성의 원인이 되고 이로 인하여 MTD를 증가시키지 못한다고 주장하였다. 반면, 위치-특이적 링커를 기반으로 제작된 ADC의 경우 링커의 안정성이 우수하여 혈관에서 안정하고 표적에 도달한 후 링커가 분해되어 약물이 방출되기 때문에 MTD를 높인다고 설명하였다. 1세대 링커의 경우 대부분 용매 노출이 심한 시스테인 이황화결합의 환원에 의하여 생성된 치올(Thiol)을 이용하여 페이로드를 접합함으로써, 약물접합에 사용된 황 원자가 혈관에서 산화된 후 페이로드가 항체로부터 이탈되어 독성을 나타냈을 가능성이 높다. 그러나 2세대 링커의 경우 시스테인을 사용하여도 약물 접합 후에 구조적으로 용매노출이 최소화 되어 체내 안정성이 유지되는 것으로 생각된다. 항체접합링커는 ADC 생산의 효율과 약물의 특성에 큰 영향을 주는 기술로 위에 소개한 기술 이외에도 많은 기업과 대학 연구소에서 큰 관심을 가지고 활발한 연구개발이 진행 중이다.
다음으로는 약물방출링커를 소개하도록 하겠다. 초기에 개발된 캐싸일라(Kadcyla)라는 ADC는 약물방출링커를 도입하지 않고 제작되었다. 즉 ADC가 암세포 안으로 내재화되면 리소좀에 도달하여 항체가 가수분해된 후 페이로드가 세포질이나 핵으로 방출되어 미세소관 억제제 혹은 DNA 손상약물로 작용함으로써 항암효과를 나타낸다. 이 과정에서 항체를 구성하던 일부 아미노산들이 페이로드에 공유결합 형태로 남아있어서 페이로드의 세포투과를 방해하므로 by-stander 효과를 보이지 못하는 단점이 있다. 이 특성은 페이로드 자체의 항암활성 저하를 초래할 수 있으며 다양한 유전형을 가진 암세포로 구성된 이질성(heterogeneous) 고형암에 대한 치료효율 감소를 초래하는 요소로 작용할 가능성이 크다. 최근에는 항체가 다 분해되기 전에도 특정 환경에서 페이로드가 항체로부터 이탈되도록 하는 절단링커(cleavable linker)를 페이로드 앞에 위치시킴으로써 ADC가 암세포에 도달할 경우 빠르게 페이로드가 항체로부터 방출되어 항암효과를 나타낸다. 일반적으로 절단링커가 암세포에서 분해되면 페이로드는 원래의 화학구조로 환원되어 세포 투과도를 회복함으로써 by-stander 효과를 통한 이차적인 항암효과를 나타낼 수 있도록 개발되고 있다.
가장 많이 사용되는 절단링커는 크게 세 가지 형태로 분류할 수 있다. 최근 ADC 개발에 가장 많이 사용되는 절단링커는 1) 암세포 리소좀에 과발현되는 효소인 카텝신 B(Cathepsin B)나 베타-글루쿠론산 분해효소(β-Glucuronidase)에 의하여 분해되는 링커; 2) 종양조직이 정상조직보다 더 산성을 띠며 세포에서 엔도좀과 리소좀이 세포 외부보다 더 산성을 띠는 생리학적 현상을 이용하여 중성 pH에서는 안정하나 산성 조건에서 잘 분해되는 하이드라존(hydrazone), 카르보네이트(Carbonate), 아세탈(acetal) 등과 같은 산-민감성(Acid-sensitive) 링커; 3) 혈관에는 매우 낮은 농도로 존재하지만 세포 내에는 높은 농도로 존재하는 글루타싸이온(Glutathione)에 의하여 쉽게 분해되는 이황화 결합 등이 절단링커로 사용되기도 한다 (그림 6). 효소에 의한 절단링커에 비교하여 이황화 결합과 산-민감성 절단링커는 암세포-선택성이 없다는 것이 단점이다. 하지만 항체의 세포 내재화 효과가 우수하지 않을 때 산-민감 링커가 산성을 띠는 종양 조직에서 천천히 분해되면서 페이로드를 방출한다면 항암효과에 도움이 될 것이다. 이 경우 심각한 부작용 방지를 위하여 세포독성이 비교적 온화한 페이로드를 사용하는 것이 바람직하다. 대표적인 ADC의 예가 삼중음성유방암 치료제로 신약승인을 받은 트로델비(Trodelvy)이다. 효소절단 링커 중 카텝신 B에 의하여 절단되는 것으로 알려진 Val-Cit링커는 신약승인을 받았거나 임상시험 중인 약 40여 개의 ADC에 사용되는 링커이나 최근 이 링커가 카텝신 B뿐만 아니라, 정상조직에도 널리 발현되는 카텝신 K나 L에 의해서도 절단되며 심지어 분화하는 호중성구 표면에 있는 에라스테이즈(Elastase)에 의하여 분해되어 호중구감소증(Neutropenia)의 원인이 된다는 것이 보고되기도 하였다[16]. 최근에는 Val-Cit보다 수용성이 좋고 카텝신 B에 대한 기질특이성이 좋은 Val-Ala 링커가 사용되고 있다. 글루쿠로네이트 링커는 음전하를 띠고 있어서 수용성이 좋고 아직 특이한 문제점이 보고되지는 않고 있다.
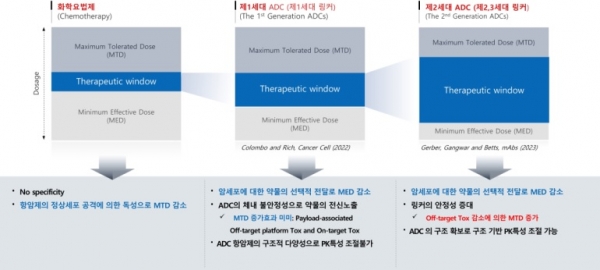
그림 6. ADC링커에 따른 약물의 약효(MED)와 독성(MTD) 변화 [13,14].
4. ADC 페이로드
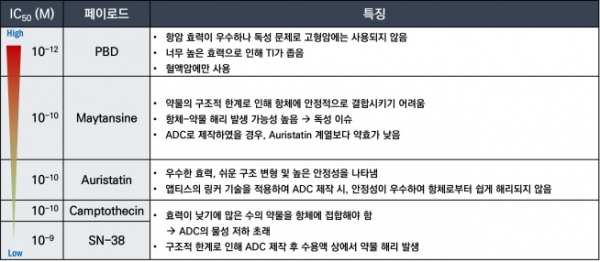
ADC 페이로드로 사용되는 세포독성항암제는 크게 미세소관억제제, DNA 손상약물, 토포이소머라제 억제제 등이 많이 사용되어 왔으며, 일반적인 표준 항암제보다 매우 높은 항암활성(IC50 = 0.01~0.1 nM)을 가진다. 식약처에서 신약승인을 받은 ADC에 사용된 페이로드의 특징을 표 2에 요약하였다. PBD나 Calicheamycin 같은 DNA에 손상약물은 주로 세포독성이 매우 강하여 혈액암 치료용 ADC에 사용되었으며 최근 Duocarmycin을 페이로드로 하는 삼중음성 유방암 치료제가 임상3상을 마쳤지만 미국 FDA로부터 신약승인을 받지 못하였다. Maytansinoid 계열인 MMAE는 현재 임상승인을 받은 12개의 ADC 중 5개의 ADC에 사용되고 있으며 토포이소머라제 억제제(SN-38과 Dxd)와 Auristatin (DM1, DM4)을 페이로드로 하는 ADC가 각각 하나씩 신약승인을 받았다. 슈도모나스 독소와 MMAF를 페이로드로 사용한 LumoxitiTM과 BlenrepTM이라는 혈액암 치료제는 한 때 신약승인을 받았으나 시장에서 각각 자진 철수하였다.
표 2. 임상사용중인 ADC 페이로드의 특성
5. 식약처로부터 신약승인을 받은 ADC
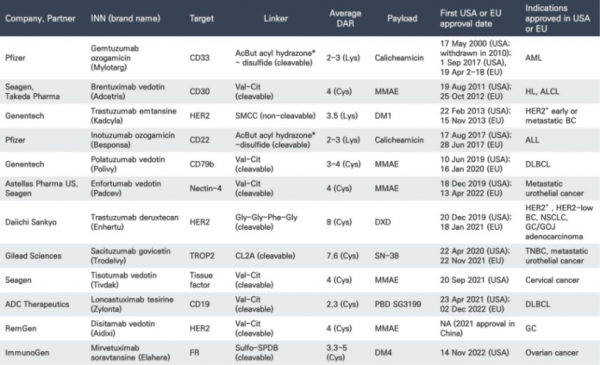
현재까지 13개의 ADC 항암제가 미국과 유럽 식약처로부터 신약승인을 받았으며, 미국과 중국에서만 신약승인을 받은 물질이 각각 1개씩 존재한다 (표 3). LumoxitiTM과 BlenrepTM이라는 약물은 미국과 유럽 식약처에서 신약승인을 받았으나 시장에서 자진 철수하여 현재는 미국에서 12개, 유럽에서 11개, 중국에서 1개의 ADC 약물의 상용화가 가능하다. 2022년 기준 Adcetris와 Kadcyla는 각각 148억 불과 227억 불의 매출을 기록하였으며 2019년 12월에 신약승인을 받은 Enhertu는 2021년 대비 190% 매출이 증가한 123억 불의 매출을 기록하였다. 미국 식약처의 자료에 따르면 현재 전 세계 임상시험기관에서 162건의 ADC 임상시험 환자를 모집 중에 있다.
표 3. 신약승인을 받은 ADC. 참고문헌 [17]의 표에서 수정하였음.
6. 결론 및 전망
비교적 짧은 역사에도 불구하고 ADC라는 표적항암제는 표적항암치료에 신기원을 가져오고 있으며, 전 세계 많은 다국적 제약사들이 경쟁적으로 ADC 신약개발에 많은 투자를 진행함에 따라 활발한 기술 이전과 기업 간 인수합병이 이루어지고 있다. 기술적인 면에서 볼 때 ADC는 이전의 저분자 항암제나 항암항체에 비하여 많은 요소기술이 필요한 약물이다. 현재 엔허투와 같은 우수한 ADC 항암제가 개발되었지만 간질성 폐질환(Interstitial lung disease, ILD)이라는 부작용이 발견되고 있어서 이를 해결할 수 있는 추가적인 기술 개발이 요구된다. 최근에는 이중항체를 사용한 ADC 개발과 환자의 면역기능 증진을 통하여 항암효과를 얻을 수 있는 ISAC (Immune-stimulation antibody conjugate)과 같은 새로운 형태의 ADC 개발이 진행되고 있다. 이와 함께 현재 항암제에 집중되어 있는 ADC의 적응증을 자가면역질환과 같은 영역으로 확장하는 시도가 이루어지고 있다. 보다 안전하고 우수한 약효를 가진 ADC를 개발하기 위해서는 기존 ADC 마커보다 암세포에 선택적인 ADC표적 항원 발굴과 세포 내재화능력이 우수한 항체개발, 보다 정교하게 항체에 약물을 접합시킬 수 있으며 체내에서는 안정성이 우수한 링커기술 개발, 그리고 부작용이 적은 페이로드 개발 등이 이루어져야 할 것이다. 진입장벽이 높은 저분자 신약에 비하여, 우리나라는 국제 경쟁력을 가진 ADC 플랫폼 기술을 보유한 전문 벤처기업들을 다수 보유하고 있으므로 ADC 기술 경쟁력에서 선진국에 뒤지지 않고 있다. 그러나 열악한 국내투자 환경으로 인한 투자유치의 어려움으로 많은 ADC 전문 벤처가 존폐의 위기에 놓여 있다. 이를 극복하기 위하여 벤처기업은 풍부한 항암제 개발경험과 자본을 보유한 제약사와의 협업이 필요한 시기가 되었다. 주지하다시피 신약개발분야에서 중국의 국제 경쟁력은 그리 높지 않았다. 그러나 중국은 현재 미국 다음으로 ADC 개발이 활성화되어 있으며, ADC가 향후 10년간 바이오제약의 먹거리라고 생각하며 활발한 민관 투자를 진행하고 있다. 그 결과 많은 ADC 신약개발기업과 CDMO사가 발전하고 있다. 우리나라는 최근 대기업을 중심으로 제조업에 해당하는 ADC CDMO 사업에 많은 투자가 이루어지고 있으나, 고위험 고부가가치를 가지며, 국가의 첨단기술 경쟁력을 상징하는 ADC 바이오신약개발 벤처에 대한 투자는 상대적으로 소극적인 편이다. ADC 벤처-기존 제약사의 활발한 협업과 정부의 과감한 투자가 선행된다면 우리나라는 ADC 신약개발에서 단시간에 전 세계 선두주자로 도약할 수 있는 충분한 능력을 가지고 있다.
참고문헌
[1] S. Baah, M. Laws, K. M. Rahman (2021) Antibody–Drug Conjugates—A Tutorial Review. Molecules 26: 2943.
[2] A. Samantasinghara, N. P. Sunildutta, F. Ahmeda, A. M. Soomrob, A. R. C. Saliha, P. Parihara, F. H. Memona, K. H. Kim, I. S. Kang, K. H. Choi (2023) A comprehensive review of key factors affecting the efficacy of antibody drug conjugate. Biomedicine & Pharmacotherapy 161: 114408.
[3] Z. Su, D. Xiao, F. Xie, L. Liu, Y. Wang, S. Fan, S. Zhou, and S. Li (2021) Antibodyedrug conjugates: Recent advances in linker chemistry. Acta Pharmaceutica Sinica B. 11: 3889-3907.
[4] J.Y. Awup, K.M. Bajjuri, M. Ritland, and P.G. Schultz (2012) Synthesis of site-specific antibody-drug conjugates using unnatural amino acids. Proc. Natl. Acad. Sci. U. S. A. 109: 16101-16106.
[5] P. Wu, W. Shui, B.L. Carlson, and C.R. Bertozzi (2009) Site-specific chemical modification of recombinant proteins produced in mammalian cells by using the genetically encoded aldehyde tag. Proc. Natl. Acad. Sci. U. S. A. 106: 3000-3005.
[6] S. Jeger, K. Zimmermann, A. Blanc, J. Grunberg, M. Honer, P. Hunziker, H. Struthers, and R. Schibli (2010) Site-specific and stoichiometric modification of antibodies by bacterial transglutaminase. Angew. Chem. Int. Ed. 49: 9995 –9997.
[7] S. Lee, D. Kim, and J. Lee (2015) Electrocatalytic production of C3-C4 compounds by conversion of CO2 on a chlorideinduced bi-phasic Cu2O-Cu catalyst. Angew. Chem. Int. Ed. 54: 14701-14705.
[8] J. Junutula, H. Raab, S. Clark, et al (2008) Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index. Nat Biotechnol. 26: 925-932.
[9] T. Lee, J. H. Kim, S. J. Kwon, J. W. Seo, S. H. Park, J. Kim, J. Jin, J. H. Hong, H. J. Kang, C. Sharma, J. H. Choi, S. J. Chung (2022) Site-selective antibody–drug conjugation by a proximity-driven S to N acyl transfer reaction on a therapeutic antibody. J. Med. Chem. 65: 5751–5759.
[10] K. Yamada, N. Shikida, K. Shimbo, Y. Ito, Z. Khedri, Y. Matsuda, B. A. Mendelsohn (2019) AJICAP: Affinity peptide mediated regiodivergent functionalization of native antibodies. Angew. Chem. Int. Ed. 58: 5592–559.
[11] R.V. Geel, M.A. Wijdeven, R. Heesbeen, J. M. M. Verkade, A. A. Wasiel, S. S. van Berkel, and F. L. van Delft (2015) Chemoenzymatic Conjugation of Toxic Payloads to the Globally Conserved N-Glycan of Native mAbs Provides Homogeneous and Highly Efficacious Antibody-Drug Conjugates. Bioconjugate Chem. 26: 2233-2242.
[12] P. Spycher, R. Schibli, M. BEHE, J. Wehrmuller (2021) Transglutaminase conjugation method and linker. US20210128743A1.
[13] R. Colombo and Jamie R. Rich (2022) The therapeutic window of antibody drug conjugates: A dogma in need of revision. Cancer Cell 40: 1255-1263.
[14] H.-P. Gerber, S. Gangwar, A. Betts (2023) Therapeutic index improvement of antibody-drug conjugates. MABS 15: 2230618.
[15] S. Ponziani, G.D. Vittorio, G. Pitari, A.M. Cimini, M. Ardini, R. Gentile, S. Iacobelli, G. Sala, E. Capone, D.J. Flavell, R. Ippoliti and F. Giansanti (2020) Antibody-drug conjugates: The new frontier of chemotherapy. Int. J. Mol. Sci. 21: 5510.
[16] H. Zhao, S. Gulesserian, M. C. Malinao, S. K. Ganesan, J. Song, M. S. Chang, M. M. Williams, Z. Zeng, M. Mattie, B. A. Mendelsohn, D. R. Stover, F. Donate (2017) A potential mechanism for ADC-induced neutropenia: Role of neutrophils in their own demise. Mol. Cancer Ther. 16: 1866-1876.
[17] C. Dumontet, J. M. Reichert, P. D. Senter, J. M. Lambert, and A. Beck (2023) Antibody-drug conjugates come of age in oncology. Nat Rev Drug Discov. 22: 641-661.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update