| 이중특이성 항체 개발을 위한 고려사항 Development of Bispecific Antibodies: Considerations for Innovative Therapies | |
|---|---|
| Date 2023-10-13 00:33:32 |
|

교수/대학원생/대학원생
서울대학교 의과대학 약리학 교실
chlee-antibody@snu.ac.kr/nicesally7@gmail.com/goldpig611@gmail.com
이중특이성 항체(bispecific antibodies, bsAbs)는 면역치료 전략의 혁신적인 진화였다. 반세기 전에 Nisonoff와 동료들이 설명한 선구적인 개념에서 나온 bsAbs는 두 개의 서로 다른 항원 결합 부위의 융합을 나타내며 이중 항원 또는 항원의 이중 에피토프 (epitope)를 동시에 표적할 수 있다. 이중특이성 항체의 이중 표적 기능은 특히 암 치료 및 염증성 장애 영역에서 기존 단일 클론 항체에 비해 상당한 이점을 제공할 수 있으며, 현재는 당뇨병, HIV 및 재생 의학과 같은 다른 질병 영역으로 확장되어 적용되고 있다.
이중특이성 항체의 개념이 등장한 이후, 수십 년 동안 개념적으로나 기술적으로 상당한 발전이 이루어졌으며, 그 결과 현재 100개 이상의 이중특이성 항체 포맷이 개발되었다. 이 중 약 4분의 1은 제약 및 생명 공학 기업의 상업적 응용을 위해 활용되고 있다. CD19xCD3 이중특이성 항체 (blinatumomab)의 임상사용 승인을 시작으로 항암제 시장 분야에서 확고한 자리를 잡았으며, 유사한 이중특이성 항체 치료제들의 유행을 이끌었다. 또한, 비암 응용 분야에서 이중특이성 항체는 뛰어난 치료 효능을 보여주었으며, 대표적인 예가 2017년 혈우병 A 치료를 위한 에미시주맙 (Factor IXa & X, Humanized IgG4)이다. 이러한 장점과 검증된 효능에도 불구하고, 여전히 다양한 한계점들과 개발 과정의 어려움을 가지고 있다.
이 리뷰에서는 이러한 이중특이성 항체를 소개하고 이중특이성 항체를 개발함에 있어 고려해야 하는 사항들을 소개하도록 하겠다.
임상사용 승인된 이중특이성 항체들
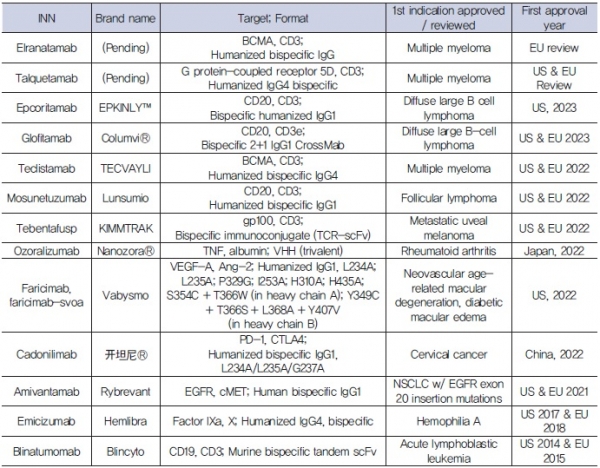
일반적인 monoclonal antibody와 비교해 이중특이성 항체는 두 가지 다른 항원 또는 항원 eptiope의 인지를 통한 향상된 표적세포 특이적 결합능 및 향상된 친화도를 가질 수 있으며, effector cell을 활성화시킬 수 있는 effector cell engager 항체와 융합해 세포독성을 향상시킬 수도 있다. 그 외에도, 표적 기관에 대한 항체 치료제의 전달 능력을 향상시키거나, 약물 저항성을 극복할 수 있게 하는 등 많은 장점들이 있으며, 이러한 장점들은 이중특이성 항체의 특성에 따라 다른 장점을 획득할 수 있다. 현재 임상사용 승인된 이중특이성 항체는 13개이며, 표 1에 정리되어 있다.
표 1. 임상사용 승인 이중특이성 항체 (Data is from antibodysociety.org)
이중특이성 항체의 디자인: 포맷
앞서 기술한 것과 같이 현재 100개 이상의 이중특이성 항체 포맷이 존재하지만, 구조적 특성에 따라 Fragment-based formats과 IgG-based formats으로 분류될 수 있다.
Fragment-based formats: Fragment-based formats의 이중특이성 항체는 IgG 항체가 가진 항원 결합부위만을 사용한 이중특이성 항체이다. 따라서 IgG 항체의 항원 결합부위인 VL (light chain variable domain)과 VH (heavy chainvariable domain)를 활용해 개발하게 된다. 가장 대표적인 Fragment-based formats의 특성은 IgG의 항원 결합부위만을 사용하기 때문에 IgG Fc domain이 없다. 따라서, Fc 도메인의 중요한 특성 중 하나인 FcRn에 의한 항체의 재순환이 이루어지지 않으며, Fc 도메인에 의한 effector function (예: ADCC, ADCP, CDC, CDCC, CDCP, NETosis,trogocytosis, etc)도 유도할 수 없다. 따라서, fragment-based formats의 이중특이성 항체는 짧은 혈중 반감기를 가지며, 최초 임상사용 승인을 받은 blinatumomab (CD19xCD3)의 혈중 반감기는 약 2-4시간에 불과하다. 이러한 Fragmentbased formats bsAb의 반감기를 늘리기 위해 IgG Fc domain 또는 albumin 결합능 항체 절편을 융합한 항체 (예:Ozoralizumab)를 활용하는 경우도 있다 (표 1 참조). HLE (Half-Life Extended) BiTE는 고전적인 BiTE 형식을 Fc 도메인에 융합하여 혈청 반감기를 크게 증가시키는 포맷이며, 연구에 따르면 CD19 HLE BiTE는 단일 정맥 주사 후 반감기가 약 210시간으로 관찰되었다.
이러한 단점들에도 불구하고, Fragment-based formats 기반의 이중특이성 항체는 간단한 설계 전략을 통해 구축될 수 있다. 대표적인 예로 화학적으로 연결된 Fab, BiTE, TandAbs 및 Bi-Nanobodies가 있다. 또한, Fragment-based formats 기반의 모듈성은 1+1, 1+2 및 2+2 디자인을 제공하는 다양한 바인딩 사이트 원자가를 용이하게 하는 장점을 가지고 있다.
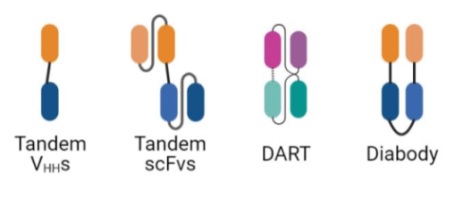
그림 1. 대표적인 Fragment-based 이중특이성 항체.
IgG-based formats: IgG-based 이중특이성 항체는 전통적인 단일클론 항체 IgG의 구조를 유지하지만 두 Fab 사이트에 대해 뚜렷한 결합 특이성을 가진다. 이중특이성 항체 들은 Fab 영역에 2개, Fc 영역에 1개 등 3개의 고유한 결합 사이트를 보유하고 있기 때문에 `‘삼중 기능 항체’라고도 불린다. 그림 2에 IgG-based 이중특이성 항체의 예시를 제시하였다.
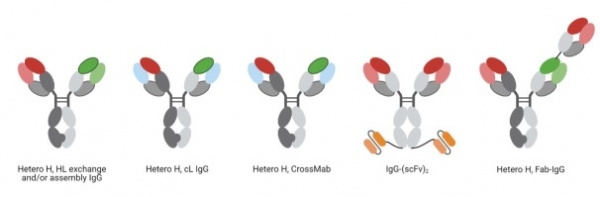
그림 2. 대표적인 IgG-based 이중특이성 항체.
역사적으로 이러한 이중특이성 항체의 생산은 쿼드로마 (quadroma) 방법에 크게 의존했었지만, 무작위성에 의존하기 때문에 비효율적인 생산방법이었다. 이후 “knobs into holes” 기술 (항체의 두 heavy chain에 각각 돌연변이를 도입함으로써 두 가지 서로 다른 heavy chain이 결합할 수 있도록 만든 기술)의 개발은 이중특이성 항체의 개발에 혁신을 유도하였다. 여기서 한 단계 더 나아가 CrossMab 형식은 “knobs into holes” 기술에서 진화했으며 또 다른 문제인 light chain 미스페어링 문제를 해결해주었다. 이러한 기술들은 IgG와 동일한 포맷을 유지한 채 이중특이성 항체를 만드는 기술이 라는 특성을 가지고 있지만, 3~4개의 polypeptide chain을 발현하기 위해 일반적으로 3~4개의 발현 벡터가 필요하다.
반면에, 개발과 생산 시스템 구축의 편의성을 위해 적은 숫자의 polypeptide를 사용한 이중특이성 항체도 있다. 대표적으로 scFv나 Fab 혹은 VHH를 IgG에 융합한 형태 (예: IgG-(scFv)2)가 있다. 융합되는 부위는 heavy chain 및 light chain의 N 말단 혹은 C 말단이 될 수 있다.
지금까지 기술한 IgG-based 이중특이성 항체는 symmetric 구조를 가지고 있다. 하지만, 두 번째 항원에 대한 항체를 하나만 융합한 형태의 asymmetric 구조를 가진 이중특이성 항체도 존재한다. 2023년에 임상사용 승인을 받은 Columvi(CD20xCD3e; Bispecific 2+1 IgG1 CrossMab)가 대표적인 예이다.
고려 사항: 1+1의 형태를 가진 이중특이성 항체는 일반적인 단일 클론 항체와 달리 one-Fab arm만을 가지고 항원에 결합하므로 친화도 측면에서 부족함이 있다. 또한, IgG-based 이중특이성 항체 개발에 있어서는 common light chain 또는 common heavy chain이 필요할 수 있는 등 여러 가지 제한 사항이 있는 format들이 존재한다. 이러한 한계를 극복하기 위해 새로운 기술과 방법이 지속적으로 개발되고 있으며, 친화성, valency, 표적 치료 기전 등을 고려해 가장 적합한 이중특이성 항체의 format을 결정하는 것이 필요하다.
이중특이성 항체의 디자인: 친화도
이중특이성 항체의 효능을 극대화하기 위해서는 각각의 항원에 대한 친화도를 정밀하게 조정해야 한다. 이러한 친화도 조정은 단순히 각 항체의 기능을 고려해 설정하는 것이 아니라 두 가지 항체의 기능을 모두 고려해서 결정해야 한다. 먼저, 항체의 기능에 따른 친화도 조정을 먼저 기술하도록 하겠다.
암세포 표적 항체의 친화도: 효과적인 이중특이성 치료제를 설계하는 과정에는 항원에 대한 특이적 결합능은 필수적 이지만, 고친화도가 반드시 효능과 비례하는 것은 아니다. 세포 표면의 수용체에 항체가 결합할 경우, 정도의 차이는 있지만 receptor-mediated endocytosis가 일어나게 되며, 이후 lysosome 경로를 통해 분해될 수 있다. 또한, 2가지 세포를 연결하는 이중특이성 항체는 trogocytosis에 의해 항원/항체 복합체가 다른 세포 쪽으로 이동되거나 이동 후 분해 되는 경우도 발생할 수 있다. trogocytosis는 각 항원에 대한 친화도가 강할 경우 더 잘 일어난다고 알려져 있다.
Translocator 항체의 친화도: 세포막 또는 혈액-뇌 장벽(BBB)과 같은 장벽을 통과하도록 설계된 항체도 친화도 조정이 필수적이다. Transferrin receptor 및 IGF1 receptor에 대한 항체가 대표적인 예시라 할 수 있다. Translocator 항체는 receptormediated transcytosis를 통해 BBB를 통과하게 되며, 이후 다시 receptor로부터 분리되어서 이동해야 한다. 따라서, translocator 항체가 고친화도를 가질 경우, transcytosis 후에도 receptor에 지속적으로 결합되어 있으므로 이동 효율이 낮아지게 된다. 하지만, 친화도가 너무 낮은 경우, receptor 결합에 의한 endocytosis 효율이 낮아질 수 있다.
T cell engager 항체의 친화도: T cell engager 항체는 종양 세포에 대한 T cell의 세포독성 잠재력을 활용하도록 디자인되어 있다. 일반적으로 고친화도를 가질수록 T cell의 세포독성을 더 강력히 유도할 수 있지만, T cell의 과도한 활성화로 인한 cytokine release syndrome (CRS)라는 부작용도 함께 가지고 있다. 이러한 CRS 부작용을 감소시키기 위해 친화도를 조정할 수 있지만, 친화도를 낮출 경우 T cell에 의한 세포독성 또한 감소된다는 문제점을 가지고 있다.
고려 사항: 이중특이성 항체를 구성하는 각 항체의 친화도는 위에서 기술한 사항을 고려해 개발되어야 하지만 더욱더 중요한 것은 두 가지 항체가 조합되었을 때이다. BiTE의 경우, 이상적인 상황은 BiTE가 암세포에 먼저 결합한 후 T cell에 결합해 암세포를 사멸시키는 것이다. 반대의 경우에는 T cell이 먼저 활성화되어 CRS가 심해질 수 있다. 만약 암세포를 표적하는 항체보다 T cell engager의 친화도가 더 높다면, BiTE는 T cell에 먼저 결합할 수 있다. 따라서, 암세포와 T cell이 균일하게 섞여 있는 조건에서 이상적으로 작용하기 위해서는 암세포에 대한 친화도가 더 높아야 할 것이다. 또한, BiTE가 암세포 혹은 T cell과 결합하는 작용에는 친화도뿐만 아니라 표적 수용체의 발현 레벨도 영향을 줄 수 있다.
혈액암이 아닌 고형암을 표적으로 한 BiTE의 경우는 고려해야 할 사항 이 더 많아진다. 일반적으로 치료용 항체는 정맥주사로 투여되므로 BiTE가 먼저 만나는 세포는 T cell이 되며, 종양의 위치로 이동하기 전까지는 암세포와 만날 수 없다. 따라서, 종양에 대한 BiTE를 개발할 경우, 단순히 친화도만으로 부작용과 효능을 조절하는 것은 매우 어렵다.
Genentech이 개발한 Columvi는 이에 대한 해답을 제시한다. Columvi (그림 2)는 2개의 암항원 표적 항체와 1개의 CD3e 항체로 이루어져 있으며, 암항원 표적 항체가 결합된 후 CD3e 항체의 CDR이 더 잘 노출되도록 디자인되어 있다. 다시 말해, columvi는 친화도가 아닌 CDR의 노출 정도를 조절해 T cell 활성화를 조정하였다.
이중특이성 항체의 디자인: Valency
Valency는 분자의 결합 부위 수를 의미하며 이중특이성 항체 설계에서 중요한 매개변수로, 이러한 혁신적인 치료제의 특이성, 효능 및 전달에 영향을 미친다. 더 높은 valency는 기본적으로 avidity를 유도할 수 있어 표적 항원에 대한 결합력을 향상시킬 뿐만 아니라 표적 항원의 clustering도 유도할 수 있다.
하지만 T cell engager의 경우, 다가 디자인보다 1가 디자인이 더 선호되고 있다. 1가 결합만으로도 종양 특이적 T cell 활성화를 유도하기에 충분하며, T cell 표면에서 CD3 분자의 가교결합으로 인한 항원 조절 또는 사이토카인 방출을 방지할 수 있다. 개발 중인 대부분의 bsTCE가 실제로 단일 CD3 결합 도메인을 포함하고 있지만 몇몇 임상 단계의 이중특이성 분자는 두개의 CD3 결합 도메인을 가지고 있다. 하지만 기능적으로 CD3에 2가 결합하는지 여부는 불분명하다.
이중특이성 항체의 미래
표적 치료제의 세계에서 이중특이성 항체(bsAbs)는 까다로운 생물학적 표적을 다루는 독특한 접근 방식을 제공하는 최첨단 솔루션으로 부상했다. 이중특이성 항체의 디자인, 기능, 잠재적 응용 프로그램은 다양하게 진화하고 있으며, 이 기사에서는 이를 위한 몇 가지 고려사항들을 소개하였다.
이중특이성 항체의 잠재력은 누구도 부인할 수 없지만 개발에는 많은 어려움이 있다. 친화도, valency 및 항원 특이성과 같은 이중특이성 항체 디자인을 위한 매개변수의 상호 연결성은 이중 표적 개념의 개발을 복잡하게 만든다. 이를 위해서는 원하는 생물학적 활성을 달성하기 위해 잠재적으로 수천 개의 결합 쌍을 스크리닝하는 통합 접근법이 필요하다. 또한, 이중특이성 항체의 복잡한 기전을 반영한 작용기전 증명을 확립하는 것이 중요하다. 이중특이성 항체의 개발 이후, 다중특이성 항체의 개발이 많은 관심을 끌고 있다. 이러한 전략을 통해 암 치료에서 여러 질병 매개 수용체를 동시에 표적으로 삼으면 수용체 중복성과 이질성을 해결하여 암세포의 약물 내성 획득 메커니즘을 최소화할 수 있다.
이중특이성 항체의 영역은 복잡한 만큼 유망하다. 정밀함과 적응력을 갖춘 이 치료의 경이로움은 가장 까다로운 생물학적 목표를 해결하는 데 새로운 희망을 제공한다. 이 분야가 계속 성장함에 따라 혁신적인 설계 전략, 기술 발전은 현대 의학에서 이중특이성 항체의 미래를 결정할 것이다.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update