| 항체-약물 접합체 개발 동향 | |
|---|---|
| Date 2023-10-12 23:36:13 |
|

교수 / 박사과정 / 석사과정
아주대학교 분자과학기술학과
taehyeonyoo@ajou.ac.kr / sangwo333@naver.com / shl0723@ajou.ac.kr
1. 서론
20세기 동안 암 치료를 위한 화학요법제의 개발은 일반적으로 약물 세포독성을 강화하는 방향으로 진행되었다. 하지만 튜불린 억제제나 DNA 알킬화제와 같은 강력한 효능을 갖는 소분자는 그 자체를 의약품으로 사용하기에는 독성이 너무 강하다. 즉, 소분자 약물의 경우 세포독성을 나타내는 최소 용량과 환자에게 독성을 나타내는 최대 허용 가능한 용량을 나타내는 치료범위(therapeutic window)가 매우 좁다. 즉, 단순히 약물의 독성을 높이는 전략은 한계에 도달하게 되었다. 이러한 약물의 치료범위를 넓히기 위해 종양 세포에 특이적으로 약물을 전달하려는 많은 시도가 있다. 항체-약물 접합체(antibody-drug conjugate; ADC)는 이러한 시도 중에 하나이다. ADC는 세포독성을 유발하는 소분자와 표적을 인지하는 항체를 연결한 분자로 기존 화학 요법의 주요 문제인 비표적 세포에 대한 독성을 줄여 치료지수를 크게 향상시켰고, 현재 항암 치료제 시장을 선도하고 있다.
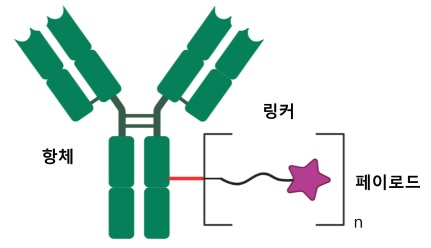
그림 1. 일반적인 ADC의 구조
ADC는 표적 세포의 항원을 특이적으로 인식하는 단일 클론 항체, 세포 사멸을 유발하는 세포 독성 소분자, 이 두 요소를 연결하는 링커의 세 부분으로 구성된다 (그림. 1). 이상적인 ADC는 종양 항원에 대해 매우 특이적으로 결합하는 단일 클론 항체, 목표에 도달하기 전까지 안정적으로 페이로드를 연결하고 표적에서 페이로드를 방출하는 링커, 항체로부터 분리된 후 세포 사멸을 유도하는 페이로드를 기반으로 한다. ADC는 혈관을 통해 이동하고 항원-항체 결합을 통해서 표적 항원을 발현하고 있는 세포에 붙는다. 이후 endocytosis 등의 과정을 거쳐 세포 내부로 이동한다. 리소좀 등 세포소기관 환경에서 항체가 분해되거나 링커가 절단되면서 자유로워진 페이로드는 세포질로 이동 후 타겟에 작용하여 세포 사멸을 유도한다 (그림. 2)[1].
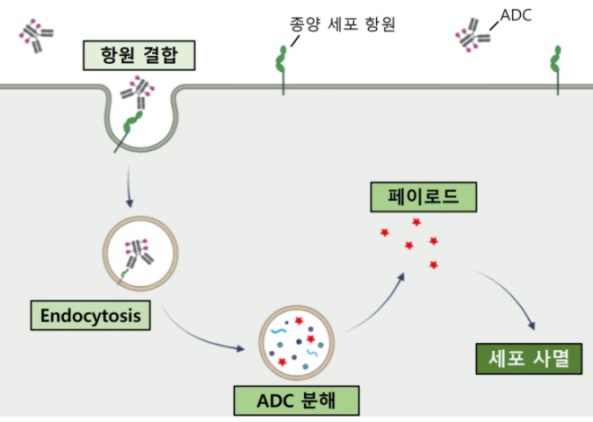
그림 2. ADC 작용 메커니즘.
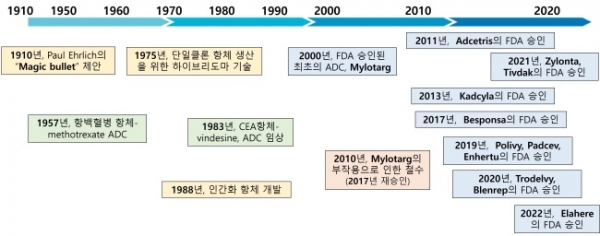
질병을 일으키는 세포에 독성 물질을 선택적으로 전달하는 개념은 1913년 독일 의사이자 과학자인 Paul Ehrlich가 제안하였다 [2]. 45년 후, 그의 표적 치료 개념은 백혈병 세포 표적 항체에 methotrexate를 접합한 ADC의 형태로 처음 입증되었으며 초기 연구에서는 다중클론 항체가 이용되었다. 최초의 ADC 인체 임상시험은 1983년 암종 배아 항원 항체-vindesine 접합체를 사용하여 수행되었다 [3]. 항체 공학의 기술 발전으로 ADC에 대한 연구가 촉진되었고, 키메라 또는 인간화 항체로 구성된 ADC 개발이 1990년대에 시도되었다 [4]. 2000년에 CD33-양성 급성골수성백혈병(CD33-acute myeloid leukemia)에 대한 gemtuzumab ozogamicin (Mylotarg)이 미국 FDA에서 최초로 승인되었다 (그림 3). Mylotarg은 표준 화학요법에 비해 임상적 이점이 부족하고 치명적인 독성을 나타낼 확률이 높아 2010년 시장에서 철수하였다. 이후 Mylotarg은 처방 농도를 줄이는 방식으로 2017년도 재승인을 받았다. 2011년에는 CD30-양성 재발성 호지킨 림프종(CD30-positive relapsed or refractory Hodgkin’s lymphoma)과 전신 역형성대세포림프종(systemic anaplastic large cell lymphoma)에 대한 brentuximab vedotin (Adcetris), 2013년에는 HER2-양성 유방암(HER2-positive breast cancer)에 대한 trastuzumab emtansine (Kadcyla)가 미국 FDA의 승인을 받았다. 같은 해에 급성 림프모구성 백혈병에 대한 Inotuzumab ozogamicin (Besponsa)에 이어서 2019년에는 미만성 거대 B세포 림프종을 대상으로 하는 polatuzumab vedotin (Polivy), 국소진행성 또는 전이성 요로상피암을 대상으로 하는 enfortumab vedotin (Padcev), HER2-양성 유방암을 대상으로 하는 trastuzumab deruxtecan (Enhertu)의 3종의 ADC가 미국 FDA의 승인을 받았다. 이후로는 2020년에 삼중음성유방암에 대한 치료제로 sacituzumab govitecan (Trodelvy)와 다발골수종에 대한 belantamab mafodotin (Blenrep)이 승인을 받았다. 2021년도에는 거대 B세포 림프종을 대상으로 하는 ioncastuximab tesirine (Zynlonta)와 자궁경부암을 대상으로 하는 tisotumab vedotin (Tivdak)이, 2022년도에는 난소암을 대상으로 하는 mirvetuximab soravtansine (Elahere)가 승인되었다. 그 외에도 최근 개발되고 있는 면역관문억제제를 포함한 면역요법과 ADC를 병용하는 전략이 효과적인 항암 치료로 자리 잡고 있고, ADC의 시장 점유율이 크게 성장할 것으로 예상된다 [5].
2. 본론
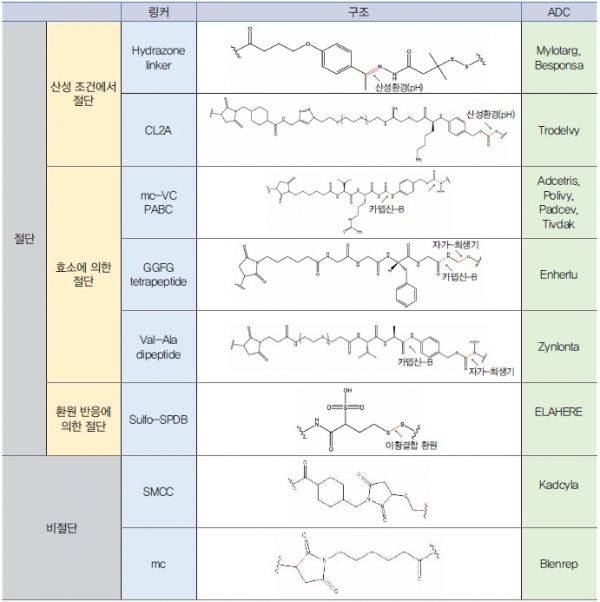
ADC를 구성하는 요소를 항체, 페이로드, 링커, 그리고 접합 방법으로 나눌 수 있다 (그림 4). 항체는 ADC가 어떤 표적을 목표로 할지 결정하며 ADC의 생체 내 지속성을 높여주는 역할을 수행한다. 페이로드는 ADC에 세포 독성을 부여하며 어떠한 메커니즘을 통해서 종양세포 사멸을 유도하는지에 따라 여러 종류로 나눌 수 있다. 링커는 페이로드와 항체를 연결하는 부분이다. 페이로드는 항체에 결합되어 있는 형태로는 독성을 나타내지 못하지만 항체가 endocytosis를 통해 분해되면 자유롭게 세포질로 가서 효과를 나타낸다. 이때 링커가 특정 조건에 따라 잘려 페이로드를 방출하는 유형과, 잘리지 않고 페이로드가 링커 일부를 포함하는 유형으로 분류된다. 또한 링커는 페이로드와 항체를 접합하는 반응을 수행하므로 페이로드가 항체의 어떤 위치에, 몇 개가 붙을지 결정한다. 제작된 ADC의 페이로드의 결합 수와 위치가 균일한 것이 약물 효능의 일관성이나 약물의 동역학적 특성에서 유리하다. 따라서 ADC의 균질성(homogeneity)과 DAR(약물 대 항체 비; Drug to antibody ratio)를 결정하는 링커 또한 ADC 제작에서 중요한 부분이다 [2].
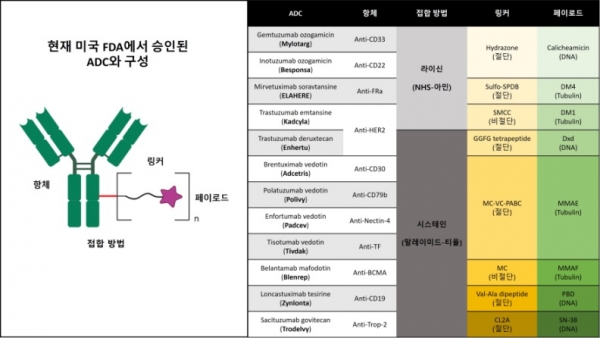
그림 4. 현재 미국 FDA에서 승인된 ADC와 이들의 구성(항체, 접합방법, 링커, 페이로드).
2.1. 항체
표적항원은 ADC의 항원-항체결합 시 암세포와 정상세포를 구분하여 효능을 나타내는 목표 특이적 독성과 연관이 있다. 따라서 적절한 표적 항원을 선택하는 것이 이상적인 ADC 개발을 위한 첫 번째 단계라고 할 수 있다. 이상적인 항원은 건강한 세포와 비교하여 암세포 표면에서 과발현되어야 하는 특성을 가져야 한다. 또한 표적 항원의 결합 가능 부위는 암세포의 외부 표면에 노출되어 ADC가 표적 항원과 세포 표면에서 결합할 수 있어야 한다. 마지막으로 표적 항원은 종양 외부에서 ADC가 결합하지 않도록 세포 외부로 잘려 나가거나 분비되지 않아야 한다. 미국 FDA에서 승인된 ADC들의 표적 항원은 CD33 (Mylotarg), CD22 (Besponsa), FRa (ELAHERE), HER2 (Kadcyla, Enhertu), CD30 (Adcetris), CD79b (Polivy), Nectin-4 (Padcev), TF (Tivdak), BCMA (Blenrep), CD19 (Zylonta), Trop-2 (Trodelvy)들이 존재한다. 위 12개의 ADC 중 6개는 혈액암이 대상이며 나머지 6개는 고형암이 대상이다. 최근 고형암에서 성공적인 임상 결과를 바탕으로 Enhertu나 Trodelvy 같이 고형암을 대상으로 하는 ADC의 개발에 대한 관심이 집중되고 있다 [6,7].
표적 항원에 대한 높은 결합 친화도 외에도 이상적인 항체는 효율적인 internalization을 보이며 낮은 면역원성과 긴 혈장 반감기를 가지고 있어야 한다. ADC 약물 개발 초기에는 쥐 유래 항체가 주로 사용되었지만 심각한 면역원성 관련 부작용으로 인해 키메라 항체와 인간화 항체로 대체되었다. 현재 ADC는 면역원성이 상당히 감소된 완전 인간화 항체를 점점 더 많이 이용하고 있으며 12개의 승인된 ADC 약물 중 Blenrep만이 키메라 항체를 사용한다. 현재 ADC 약물에 사용되는 항체는 모두 면역글로불린 G(IgG) 항체로, 여기에는 IgG1, IgG2, IgG3, IgG4의 4가지 아형이 있다. ADC에 흔히 사용되는 아형인 IgG1은 혈청에서 가장 풍부하게 존재하며 Fc 수용체와의 높은 결합력으로 ADCC (antibodydependent cell-mediated cytotoxicity), ADCP (antibody dependency phagocytosis), CDC (complement-dependent cytotoxicity)와 같은 기능을 유도할 수 있다. IgG3는 짧은 반감기 때문에 ADC에서 거의 사용되지 않는다. IgG2는 종종 생체 내에서 이량체나 응집체를 형성하는 경향을 보이며, 이는 ADC 약물의 농도 감소로 이어진다. IgG4는 Fab-arm 교환이 발생하기 때문에 효능이 감소하는 문제로 잘 사용되지 않는다 [8].
항체의 큰 크기는 ADC의 혈관 투과나 종양 조직 침투에 장애로 작용할 수 있다. 이를 극복하는 전략으로 연구자들은 소형화된 항체(예, scFv, Fab, nanobody)를 ADC 개발에 시도하고 있다 [8]. 그러나 이에는 ADC의 생체 내 반감기 감소를 유발하는 단점 또한 존재한다. 항체 엔지니어링의 새로운 전략 중 하나는 두 개의 서로 다른 표적 항원을 표적으로 삼는 이중특이성 항체이다. 두 개의 항원에 결합하기 때문에 이중특이성 항체로 이루어진 ADC는 두 항원을 동시에 발현하는 세포에 좀 더 특이적으로 결합할 수 있다. 종양세포는 단일 항원의 발현양이 줄어드는 방식으로 ADC에 대한 내성을 얻게 되는 경우가 있는데 이중특이성 항체는 다른 하나의 항원에도 결합하므로 ADC의 효능감소를 완화할 수 있다. 마지막으로 미세종양환경에서 특이적으로 활성화되는 항체를 이용한 접근법이다. 대표적인 예로, Probody는 항원 결합부위가 펩타이드로 막혀있어 종양 바깥에서는 항원과 결합하지 못한다. 하지만 미세종양환경에 존재하는 프로테아제에 의해 펩타이드가 잘려 나가고 주변에 있는 항원을 발현하는 세포와 결합하게 된다. 이를 통해서 일반적인 항체에 비해 더 특이적으로 목표 세포에서 효과를 보이는 것이 가능하다 [9].
2.2. 페이로드
미국 FDA에서 승인된 ADC와 개발 중인 많은ADC의 페이로드는 튜불린 억제제 또는 DNA 손상제이다 (그림 5). 튜불린 억제제는 튜불린 중합을 억제하여 세포 주기를 정지시키고 세포 사멸을 유도하는 약물로 미국 FDA에 승인받은 ADC에 auristatin계, maytansinoid계가 사용되고 있다. Auristatin계의 약물은 MMAE와 MMAF가 있으며, Adcetris, Polivy, Blenrep, Padcev, Tivdak의 페이로드이다. Maytansinoid계는 그 다음으로 많이 사용되고 있으며 Kadcyla의 DM1과 ELAHERE의 DM4가 사용되고 있다. 이외에도 튜불린 억제제로 ADC 개발에 시도되고 있는 약물로는 tubulysin계열이 있다.
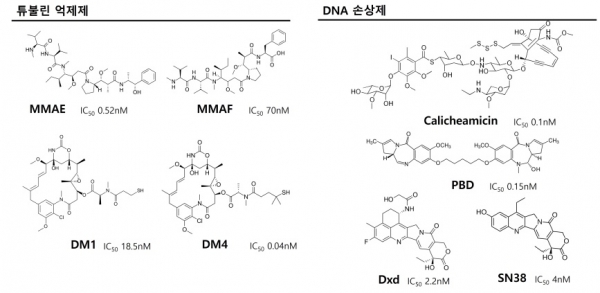
그림 5. 현재 미국FDA에서 승인받은ADC의 페이로드들.
승인받은 ADC에 사용되는 두 번째 범주 페이로드인 DNA 손상제는 calicheamicin, camptothecin, pyrrolobenzodiazepines(PBD)계가 있다. Calicheamicin 계열은 DNA와 결합하여 DNA 복제 과정을 방해하여 세포독성을 나타내며 이 계열의 약물인 ozogamicin은 Mylotarg와 Besponsa의 페이로드이다. Camptothecin계인 SN-38과 Dxd는 각각 Trodelvy와 Enhertu의 페이로드로 사용되었다. Zynlonta의 페이로드인 PBD가 나타내는 이합체 형태는 화합물이 DNA 가닥에 교차로 결합할 수 있게 하여 세포사멸을 유도한다. 그 외에도 ADC 개발에 사용되는 페이로드로 Duocarmycin계 약물은 핵산 구조를 파괴하고 전체 DNA 구조에 영향을 미치는 DNA의 비가역적 알킬화를 유발함으로써 독성을 나타낸다. Anthracycline계는 DNA 합성을 억제하며 해당하는 약물로 doxorubicin이 있다.
튜불린 억제제와 DNA 손상제 이외에도 다양한 종류의 페이로드들이 ADC 개발에 활용되고 있다. 예를 들어, RNA 폴리머라제 억제제인 amatoxin, HDAC 억제제, Bcl-xL 억제제, 티로신 키나아제 억제제 등이 세포독성 페이로드로 이용되고 있다. 또한, 고형암 환경에 존재하는 면역시스템 활성화를 목표로 STING 작용제나 TLR 작용제를 페이로드로 사용한 ADC가 개발되고 있다. 그 외에도, 타겟 단백질의 분해를 유도하는 소분자(molecular glue, PROTAC)와 항체를 링커로 연결한 ADC도 연구되고 있다 [10].
2.3. 링커
링커는 항체와 페이로드를 연결한 체내 순환 중 높은 안정성과 표적에서의 페이로드 방출을 가능하게 하는 ADC의 구성 요소이다. 링커의 종류는 생체 내에서 절단 유무에 따라서 크게 비절단 링커와 절단 링커로 나눌 수 있다 (표 1) [1].
2013년 미국 FDA의 승인을 받은 Kadcyla는 인체 내 환경에서 절단되지 않는 링커인 SMCC를 이용하여 개발되었다. 비절단 링커로 연결된 페이로드는 리소좀에서 항체가 분해된 후에야 세포질로 방출되기 때문에 체내 순환 중 높은 안정성을 가질 수 있다. 하지만 비절단 링커는 Kadcyla의 약물인 DM-1과 같이 링커의 일부가 약물에 붙어 있어도 효능에 큰 영향이 없는 경우에 한해서 적용이 가능하다는 특징이 있다.
절단 링커는 종양 환경에서 절단될 수 있으며, 임상적으로 승인된 ADC의 80% 이상이 절단 링커를 사용한다. 2000년 처음 미국 FDA에서 승인받은 Mylotarg는 산성 조건에서 불안정한 하이드라존(Hydrazone) 링커를 사용하였다. 하이드라존 링커는 ADC가 pH가 낮은 엔도좀(pH 5.0-6.0)과 리소좀(pH 약4.8)으로 이동하여 가수분해됨으로써 페이로드가 항체로부터 분리된다. 하지만, 해당 링커는 중성 환경에서도 절단이 일어나기 때문에 표적에 도달하기 전에 ADC로부터 페이로드가 분리될 수 있어 정상세포에 대한 세포독성을 유발할 수 있다. Mylotarg은 안전성 문제로 2010년 시장에서 철수하였고 2017년 용량을 낮추고 용법 변경하여 재승인을 받았다. 동일한 링커-약물 조합을 사용한 Besponsa는 2017년에 미국 FDA 품목허가를 받았다. 산성 조건에서 분해 가능한 carbonate 링커를 사용한 Trodelvy는 2020년에 FDA 승인을 받았다.
2011년 두 번째로 미국 FDA에서 승인받은 Adcetris의 경우 엔도좀과 리소좀에 존재하는 단백질 분해 효소인 카뎁신-B 의해 절단되는 링커로 제작되었다. 카텝신-B는 다양한 암 세포에서 과발현되고, 페닐알라닌-라이신(Phe-Lys) 및 발린-시트룰린(Val-Cit)과 같은 특정 서열을 인식하여 펩티드 결합을 절단한다. Adcetris는 Val-Cit 아미노산 서열을 포함하는 링커가 사용되었고 카뎁신-B에 의해 링커가 절단된 후 자가-희생기인 PABC의 2차 절단 반응을 거쳐 약물인 MMAE가 독성을 나타내는 상태로 분리된다. 동일한 링커-약물을 사용한 ADC에는 Polivy, Padcev, Tivdak이 있고, 카뎁신-B가 절단하는 서열이 tetrapeptide로 변경된 Enhertu와 Val–Ala 서열로 변경된 Zynlonta가 각각 2019년, 2021년에 미국 FDA 승인을 받았다.
이황화결합이 포함된 링커는 세포 외 환경과 비교하여 글루타티온과 같은 환원성 분자의 농도가 높은 세포질에서 절단되면서 페이로드를 방출한다. 2022년 승인된 Elahere는 이황화결합이 포함된 링커를 기반으로 개발되었다.
새로운 ADC 개발에 있어 기존에 사용되지 않은 절단 메커니즘을 이용한 링커들이 보고되고 있다. 리소좀에 존재하는 다른 효소의 기질을 활용한 링커가 그 중 하나이다. 예를 들어, 베타-글루쿠로니다아제는 일부 종양에서 과발현되며, 이 효소의 기질인 베타-글루쿠로니드가 포함된 링커를 이용해 종양 세포에서 페이로드를 선택적으로 방출할 수 있다. 또 다른 절단 메커니즘으로는 생물직교클릭화학을 이용한 클릭-절단 반응이 있다. ADC 처방 후 외부에서 체내 물질과는 반응하지 않는 물질을 넣어 원하는 시점에 독성 페이로드의 방출이 가능한 기술이다. 이 밖에도 Fe(II) 이온에 의해 절단 가능한 링커, 광 반응 절단 가능한 링커가 개발되고 있다 [11].
2.4. 항체와 링커의 접합 방법
일반적으로 사용되는 비특이적 접합 방법 중 하나는 라이신의 아민 그룹과 링커에 도입된 NHS (N-HydroxySuccinunmide)와의 반응을 이용한 방법이다 (그림 6). Mylotarg, Kadcyla, Besponsa, Elahere가 이 방법으로 제조되고 있다. 그러나 일반적인 항체에는 약 80개의 라이신 잔기가 있고 약 10개의 잔기가 화학적으로 접근 가능하기 때문에 불균질한 DAR과 여러 약물 접합부위를 갖는 ADC가 생성된다. 또한, 전하를 갖는 아민이 참여하는 반응은 접합체의 물성에도 영향을 줄 수 있으며 항원 결합 부분에 위치한 라이신과 접합할 경우 원 항체에 비해 낮은 항원 결합력을 갖게 된다.
또 다른 접합 방법은 항체에 존재하는 시스테인의 티올 그룹과 링커에 도입된 말레이미드와의 반응을 이용한 ADC 제조 방법이다 (그림 6). 가장 일반적으로 사용되는 IgG1에는 4개의 사슬 간 이황화결합과 12개의 사슬 내 이황화결합이 있다. 4개의 사슬간 이황화결합을 환원시켜 환원 정도에 따라 최대 8개의 티올 그룹을 만들어 낼 수 있다. 제한된 수의 접합 부위와 티올 그룹의 높은 반응성으로 시스테인 접합을 이용하면 라이신 접합보다 균질한 ADC를 얻을 수 있다. 이 방법으로 Adcetris가 개발되었고 이후에도 Polivy, Padcev, Enhertu, Trodelvy, Blenrep, Zynlonta, Tivdak 등의 ADC가 개발되었다. 하지만 접합을 위해 환원된 이황화결합은 항체의 구조 안정성에 영향을 미치고 여전히 불균질한 ADC가 만들어지게 된다 [12].
라이신 접합과 시스테인 접합의 불균질한 특성을 극복하기 위해 위치 특이적 접합 방법들이 개발되고 있다. 항체에 추가적인 시스테인을 도입하는 THIOMAB 기술은 도입되는 시스테인 위치로 접합 위치를 결정하고 균질한 ADC 생산이 가능하다. 또한 빠른 속도로 생물직교클릭반응이 가능한 비천연 아미노산을 항체에 도입하여 링커를 접합하는 방법과 sortase, transglutaminase와 같은 효소가 인지할 수 있는 펩타이드 서열을 항체 도입하여 링커를 접합하는 방법이 개발되었다 [3].
항체의 아미노산 서열의 변경 없이 항체와 링커를 접합하는 방법도 개발되고 있다. 시스테인 리브리징은 항체의 이황화결합을 환원시킨 후 생겨난 티올 그룹에 다른 링커를 도입하는 방법으로 항체에 존재하는 모든 이황화결합에 도입될 경우 균질한 ADC 제조가 가능하다. 그리고 항체에 친화도를 갖는 펩타이드를 사용한 affinity guided 접합 방법은 전처리과정 없이 위치 특이적이고 균질한 ADC를 만들 수 있다 [13].
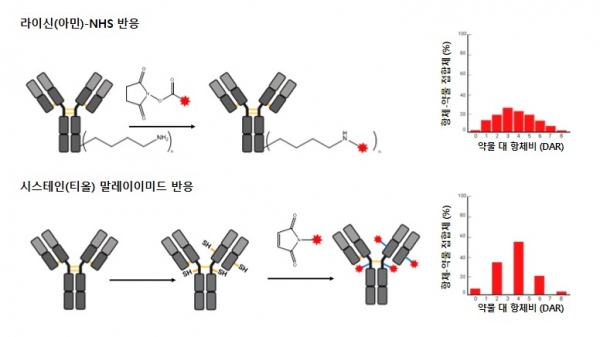
그림 6. 라이신과 시스테인을 이용한 항체와 링커의 접합.
3.맺음말
타겟 세포를 선택적으로 사멸시킬 수 있는 ADC는 2000년에 미국 FDA에서 최초로 승인을 받은 이후로 개발이 가속되고 있다. 12개의 승인을 받은 약물 중 2019년도 이후에만 8개의 약물이 승인받았다. ADC는 항체와 페이로드가 링커를 통해서 연결되어 있고 세 요소가 모두 주요한 역할을 수행한다. 때문에 ADC 제조에 있어서 항체, 페이로드, 링커의 조합과 새로운 기술 개발이 필요하다. 항체 관련 기술을 통해서 어떤 항원을 인지할지 결정하는 것, 표적 세포에 더 많은 약물이 도달하는 것과 비표적 세포에 더 적은 약물이 전달되게 만드는 것이 목표일 것이다. 페이로드 측면에서는 여러 메커니즘에 의한 직접적인 세포사멸 뿐만 아니라 면역반응 활성화나 목표 단백질 분해와 같이 다양한 기능을 수행하는 물질이 개발되고 있다. 항체와 페이로드 둘 사이를 연결하는 링커는 ADC의 약물동역학과 치료범위에 큰 영향을 주기 때문에 더 효과적인 ADC를 위한 새로운 링커와 접합방식이 만들어지고 있다. ADC를 구성하는 항체, 페이로드, 링커 모두 ADC의 특성에 관여하기 때문에 한 요소만 단순히 변경하여 원하는 특성을 갖는 약물을 만들기는 어렵다. 앞으로는 다양한 구성요소들의 개발과 그 조합을 통해서 더 많고 효과적인 ADC들이 등장할 것으로 기대된다.
참고문헌
1. Chau, C. H., P. S. Steeg, and W. D. Figg (2019) Antibody-drug conjugates for cancer. Lancet 394: 793-804.
2. Fu, Z., S. Li, S. Han, C. Shi, and Y. Zhang (2022) Antibody drug conjugate: the “biological missile” for targeted cancer therapy. Sig. Transduct Target Ther. 7: 93.
3. Tsuchikama, K. and Z. An (2018) Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell 9: 33-46.
4. Khongorzul, P., C. J. Ling, F. U. Khan, A. U. Ihsan, and J. Zhang (2020) Antibody-drug conjugates: A comprehensive review. Mol. Cancer Res. 18: 3-19.
5. Baah, S., M. Laws, and K. M. Rahman (2021) Antibody-drug conjugates-A tutorial review. Molecules 26: 2943.
6. Siddiqui, T., P. Rani, T. Ashraf, and A. Ellahi (2022) Enhertu (Fam-trastuzumab-deruxtecan-nxki) - Revolutionizing treatment paradigm for HER2-Low breast cancer. Ann. Med. Surg. (Lond) 82: 104665.
7. Syed, Y. Y. (2020) Sacituzumab Govitecan: First Approval. Drugs 80: 1019-1025.
8. Lucas, A. T., A. Moody, A. N. Schorzman, and W. C. Zamboni (2021) Importance and considerations of antibody engineering in antibody-drug conjugates development from a clinical pharmacologist’s perspective. Antibodies (Basel) 10: 30.
9. Chomet, M., M. Schreurs, M. Nguyen, B. Howng, R. Villanueva, M. Krimm, O. Vasiljeva, G. A. M. S. van Dongen, and D. J. Vugts (2020) The tumor targeting performance of anti-CD166 Probody drug conjugate CX-2009 and its parental derivatives as monitored by (89)Zr-immuno-PET in xenograft bearing mice. Theranostics 10: 5815-5828.
10. Conilh, L., L. Sadilkova, W. Viricel, and C. Dumontet (2023) Payload diversification: a key step in the development of antibody-drug conjugates. J. Hematol. Oncol. 16: 3.
11. Su, Z., D. Xiao, F. Xie, L. Liu, Y. Wang, S. Fan, X. Zhou, and S. Li (2021) Antibody-drug conjugates: Recent advances in linker chemistry. Acta Pharm. Sin. B. 11: 3889-3907.
12. Agarwal, P. and C. R. Bertozzi (2015) Site-specific antibody-drug conjugates: the nexus of bioorthogonal chemistry, protein engineering, and drug development. Bioconjug. Chem. 26: 176-192.
13. Park, J., S. Lee, Y. Kim, and T. H. Yoo (2021) Methods to generate site-specific conjugates of antibody and protein. Bioorg. Med. Chem. 30: 115946.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update