| 단일 도메인 항체의 특성 및 활용방안 | |
|---|---|
| Date 2023-10-02 18:43:17 |
|

교수 / 학생연구원
성신여자대학교 바이오신약의과학부
jhna@sungshin.ac.kr / kws8899@gmail.com
1. 서론
인류 문명이 발달함에 따라 코로나바이러스 감염증-19(COVID-19)와 같은 새로운 신규 감염성 질환 또한 끊임없이 등장하고 있다. 이에 따라 신규 감염성 질환을 치료하거나 진단할 수 있는 바이오메디컬소재를 개발하는 바이오헬스 산업의 성장 또한 가속화되고 있는 상황이다. 다양한 바이오메디컬소재들 중 치료제 및 진단 분야에 모두 활용되고 있는 항체(Antibody)에 대한 수요는 이러한 바이오헬스 산업의 성장에 발맞춰 함께 증가하고 있다.
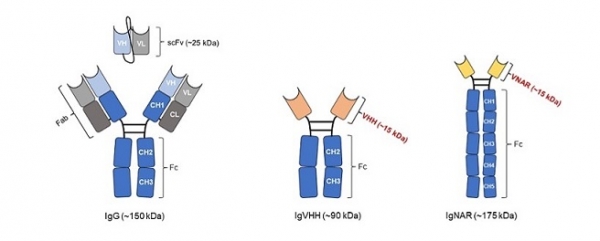
일반적으로 통용되는 항체는 면역글로불린 G(Immunoglobulin G, IgG) 형태로써, 2개의 heavy chain과 2개의 light chain으로 구성된 150 kDa의 단백질을 의미한다. 많은 항체 분야 연구자들은 바이오의약품 혹은 신속진단키트의 탐침자(probe)로써 IgG 자체를 활용하거나, 항원 결합 절편(Antigen binding fragment, Fab) 혹은 가변부위(Variable region)를 인위적으로 연결한 단일사슬항체(Single chain antibody, scFv)와 같은 항체절편(Antibody Fragment)들을 활용하기도 한다.
1990년대 낙타류(Camelidae) 및 연골어류(Chondrichthyes)에서 heavy chain으로만 구성되어 있는 heavy chain only antibody(HCAb)가 발견되었고, 항체 분야 연구자들은 HCAb의 Fab 부위(낙타류의 경우는 VHH, 연골어류의 경우는 VNAR라고 명명함)에 관심을 가지기 시작하였다. IgG의 Fab과는 달리 HCAb의 Fab은 heavy chain의 constant domain 1 또한 없는 것을 알게 되었고, HCAb Fab의 작은 size의 특성을 지칭하기 위해 나노바디(Nanobody, Nb)라고 불리거나, heavy chain에서만 유래된 Fab인 것을 강조하기 위하여 단일 도메인 항체 (Single domain antibody, sdAb)라고도 불리고 있다. 2019년 최초의 단일 도메인 항체 기반의 치료제인 Caplacizumab1)이 FDA에 의약품 판매 승인이 된 이후로, 많은 의약품 및 진단 분야의 연구자들이 단일 도메인 항체에 대한 관심도가 급격하게 올라가고 있다. 본 기고에서는 단일 도메인 항체가 치료제 및 진단 분야에서 활용되었을 때의 장점을 살펴보고, 이를 이용한 활용방안 또한 살펴보고자 한다.
2. 단일 도메인 항체의 특징
단일 도메인 항체의 가장 큰 특징은 우선 크기가 작다는 점이다. 단일 도메인 항체는 IgG를 활용하여 만들 수 있는 가장 작은 항체 절편인 scFv (약 25 kDa) 보다 더 작은 크기 (약 15 kDa)를 가지고 있기 때문에, 입체장애를 일으킬 확률이 적어 항원 접근성이 용이하다는 특징을 가지고 있다. 뿐만 아니라 항원 결합에 가장 중요한 역할을 한다고 알려져 있는 항체의 가변부위인 3번째 상보성 결정 부위 (Complementary determining III region, CDR3)가 IgG에 비해 매우 길기 때문에 (현재 보고된 논문 기준 최대 34개 아미노산으로 이루어진 CDR3가 발견됨), 효소의 활성화 부위와 같이 3차 구조적으로 복잡한 형태의 항원부위(Cyptic epitope)에도 선택적으로 결합할 수 있는 항체가 개발이 가능하다는 장점을 가지고 있다. 또한 단일 도메인 항체는 일반적으로 열 안정성, 화학적 안정성 등이 IgG 및 그 항체절편들에 비해 우수할 뿐만 아니라 수용화도가 높아, 대장균부터 포유류 세포 기반의 단백질 발현 시스템 모두에서 과발현이 가능하고 다양한 형태로 엔지니어링이 용이하다는 장점을 가지고 있다.
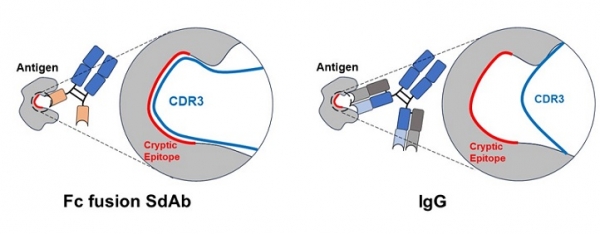
그림 2. 항원 결합 관점에서 IgG 대비 단일 도메인 항체의 장점 모식도.
두 개의 단일 도메인 항체인 VHH와 VNAR의 특징을 비교해서 살펴보면, 우선 VHH의 경우는 framework 2 부분을 제외한다면2) 인간의 heavy chain과 매우 유사한 아미노산 서열을 가지고 있기 때문에, 소수의 아미노산 치환만으로도 인간화가 쉽게 가능하다는 특징이 있는 반면, VNAR는 인간의 heavy chain과 서열이 많이 다르기 때문에 인간화가 다소 도전적이다. 하지만 최근 VNAR를 인간화한 결과들이 많이 보고되고 있기 때문에 추후 방법론이 구축될 것으로 기대된다. 대신 VNAR는 VHH와는 다르게 항원 결합에 중요한 가변 부위가 CDR 2개 Hyper variable (HV) 2개로 총 4개가 있어 좀 더 독특한 항원 결합 부위를 가진 항원들에도 우수한 결합력을 가지는 항체가 발굴될 가능성이 있을 뿐만 아니라, 아직 연구 진행 사항이 전 세계적으로 초기 단계이기 때문에, VNAR 연구를 지금 시점에 시도하더라도 선도적인 연구가 가능한 장점을 가지고 있다.
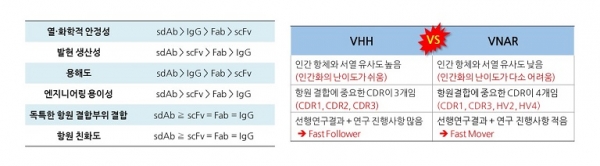
그림 3. 항체 platform별 (좌) 및 단일 도메인 항체별 (우) 특징 비교.
3. 항체공학적 측면에서 단일 도메인 항체 활용 방안
앞서 언급한 단일 도메인 항체의 생물리화학적 장점들 때문에, 항체공학적인 방법을 활용하면 치료제 및 진단키트의 탐침자로써 활용할 수 있는 다양한 형태의 단일 도메인 항체 기반의 바이오메디컬소재를 개발할 수 있다. 본문에서는 현재 활용되고 있는 대표적인 단일 도메인 항체 기반 바이오메디컬소재 platform들을 살펴보고자 한다.
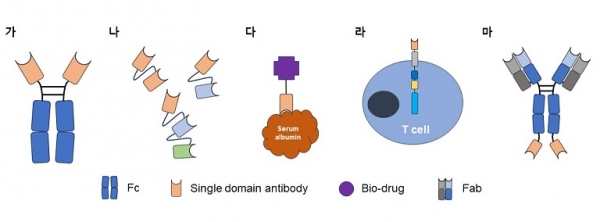
그림 4. 단일 도메인 항체가 적용된 다양한 형태의 바이오메디컬소재 모식도.
가) Fc domain이 융합된 sdAb
치료제 및 신속 진단 키트의 탐침자로 개발될 때 가장 많이 시도되고 있는 platform으로써, 인간 Fc domain3)이 단일 도메인 항체 c-말단 부분에 융합된 구조를 가지고 있다. Fc를 결합하면 dimer로 단백질이 발현이 되기 때문에 avidity에 의한 결합력 증대 효과를 나타낼 수 있을 뿐만 아니라, 혈중 반감기 증대 효과와 effector function을 Fc domain을 통해 확보할 수 있는 장점을 가지고 있다. 또한 IgG가 가질 수 있는 장점들을 모두 확보할 수 있음에도 크기는 약 80 kDa으로 여전히 작고 물성 또한 우수하다. 신속 진단 키트 탐침자로 Fc domain이 융합된 sdAb을 활용하는 경우, 작은 크기 때문에 단위 면적 당 항체를 IgG 대비 더 많이 표면에 고정화할 수 있어, 같은 결합력을 가진다고 가정한다면 IgG 보단 Fc가 융합된 단일 도메인 항체가 진단 감도를 향상시킬 수 있다. 그리고 Knob into hole과 같이 서로 다른 Fab을 가질 수 있는 개량된 Fc domain을 활용한다면, 이중항체로도 개발이 가능하다.
나) Polyvalent sdAb
크기가 작고, 물리화학적 특성이 우수한 단일 도메인 항체의 특성을 가장 잘 살린 platform으로써, 2개 이상의 단일 도메인 항체를 peptide linker (GS linker, alanine linker 등)로 연결하여 발현시킨 구조를 가지고 있다. Linker로 연결된 단일 도메인 항체는 같은 아미노산을 가진 단일 도메인 항체를 연결한 homovalent 뿐만 아니라 다른 아미노산을 가진 단일 도메인 항체를 연결한 heterovalent 또한 제작이 가능하다. 그리고 bivalent 뿐만 아니라 trivalent, tetravalent 등 2개 이상의 단일 도메인 항체를 연결한 형태 또한 다양하게 개발되고 있다. 2019년 FDA에 의약품 판매 허가 승인이 된 Caplacizumab 또한 alanine linker (AAA)로 연결된 homo-bivalent 단일 도메인 항체치료제이다. 본 platform은 다중 특이적, avidity 유도 등의 장점은 있지만 혈중 반감기가 다소 낮다는 단점을 가지고 있다. 하지만 Caplacizumab처럼 짧은 반감기가 필요한 치료제를 개발할 때에는 avidity에 의하여 강한 결합력을 유도할 수 있기 때문에 유용한 platform이라고 할 수 있다. 그리고 polyvalent sdAb은 대장균과 같이 실험 소요시간이 적게 들고, 비용이 저렴한 단백질 발현 시스템으로도 과발현이 쉽기 때문에, 제품 개발 시 개발 소요시간을 단축시키고, 생산 단가 또한 낮출 수 있다는 장점을 가지고 있다.
다) 혈중 반감기 증대용 sdAb
효능은 좋으나 크기가 작아 혈중 반감기가 낮은 peptide와 같은 biodrug의 반감기를 올리기 위해 활용되는 platform으로써, 반감기를 향상 시키고자 하는 biodrug에 serum albumin에 결합하는 단일 도메인 항체를 융합하여 발현시키는 방법이다. 대표적인 serum albumin 표적 단일 도메인 항체는 GSK사의 AlbuAb이 있으며, 그 외에도 다양한 연구팀들이 serum albumin에 결합하는 단일 도메인 항체들을 발굴하고 있는 상황이다.
라) CAR-T(혹은 CAR-NK)의 chimeric receptor로써 sdAb 활용
CAR-T의 chimeric receptor로 주로 활용되는 scFv의 경우, 물리화학적 특성이 일반적으로 좋지 않기 때문에 CAR-T를 개발하는 많은 연구자들은 물리화학적 특성이 우수한 scFv를 발굴하기 위해 많은 노력을 기울이고 있다. 단일 도메인 항체는 앞서 언급했던 대로 물리화학적 특성이 우수하기 때문에, CAR-T의 chimeric receptor로써 단일 도메인 항체를 활용한다면 CAR-T 개발 성공 가능성을 높일 수 있다. 실제로 많은 CAR-T 연구자들이 단일 도메인 항체를 활용하고 있으며, 2022년 2월에는 chimeric receptor로써 BCMA를 표적하는 VHH를 활용한 CAR-T 치료제인 CARVYKTI가 FDA에 판매 승인되었다.
마) 신규 이중항체 platform에 적용된 sdAb
이중항체 platform은 다양하게 진화하고 있고, 현재에는 IgG와 다른 표적에 결합하는 scFv를 IgG heavy chain의 N-말단 혹은 C-말단에 융합하거나, light chain의 N-말단 혹은 C-말단에 융합한 형태의 이중항체들도 개발되고 있다. 하지만 위에 언급했던 대로 scFv는 일반적으로 물리화학적 특성이 좋지 않기 때문에, 일부 scFv의 경우 IgG에 융합 시 이중항체 자체가 생산이 안되는 문제가 발생하기도 한다. 이러한 문제는 scFv 대신 단일 도메인 항체를 융합한다면 극복이 가능할 것으로 기대된다.
참고문헌
Harmsen, M. M. and H. J. De Haard (2007) Properties, production, and applications of camelid single-domain antibody fragments. Appl. Microbiol. Biotechnol. 77: 13–22.
Cheong, W. S., C. Y. Leow, A. B. A. Majeed, and C. H. Leow (2020) Diagnostic and therapeutic potential of shark variable new antigen receptor (VNAR) single domain antibody. Int. J. Biol. Macromol. 147: 369-375.
Fernandez-Quintero, M. L., A.-L. M. Fischer, J. Kokot, F. Waibl, C. A. Seidler, and K. R. Liedl (2022) The influence of antibody humanization on shark variable domain (VNAR) binding site ensembles. Front. Immunol. 13: 953917.
Kim, W. S., H. D. Chae, I. Jung, W.-K. Lee, W. J. Lee, J. Lee, Y. Gong, D. Lee, B.-W. Kim, J.-K. Kim, J. Hwang, D.-H. Kweon, S. T. Jung, and J.-H. Na (2023) Isolation and characterization of single domain antibodies from banded houndshark (Triakis scyllium) targeting SARS-CoV-2 spike RBD protein. Fish Shellfish Immunol. 138: 108807.
Jin, B.-K., S. Odongo, M. Radwanska, and S. Magez (2023) Nanobodies: A review of generation, diagnostics and therapeutics. Int. J. Mol. Sci. 24: 5994.
Khalid, Z., Y. Chen, D. Yu, M. Abbas, M. Huan, Z. Naz, H. M. Mengist, M.-j. Cao, and T. Jin (2022) IgNAR antibody: Structural features, diversity and applications. Fish Shellfish Immunol. 121: 467-477.
Scully, M., S. R. Cataland, F. Peyvandi, P. Coppo, P. Knöbl, J. A. K. Hovinga, A. Metjian, J. de la Rubia, K. Pavenski, F. Callewaert, D. Biswas, H. De Winter, and R. K. Zeldin (2019) Caplacizumab treatment for acquired thrombotic thrombocytopenic purpura. N. Engl. J. Med. 380: 335-346.
O’Connor-Semmes, R. L., J. Lin, R. J. Hodge, S. Andrews, J. Chism, A. Choudhury, and D. J. Nunez (2014) GSK2374697, a novel albumin-binding domain antibody (AlbudAb), extends systemic exposure of exendin-4: First study in humans—PK/PD and safety. Clin. Pharmacol. Ther. 96: 704-712.
Abebe, E. C., M. Y. Shiferaw, F. T. Admasu, and T. A. Dejenie (2022) Ciltacabtagene autoleucel: The second anti-BCMA CAR T-cell therapeutic armamentarium of relapsed or refractory multiple myeloma. Front. Immunol. 13: 991092.
Liu, C., H. Lin, L. Cao, K. Wang, and J. Sui (2022) Research progress on unique paratope structure, antigen binding modes, and systematic mutagenesis strategies of single-domain antibodies. Front Immunol. 13: 1059771.
1) 후천성 혈소판감소성 자반증(Acquired thrombotic thrombocytopenic purpura) 치료제
2) Framework 2 부분은 인간의 heavy chain variable region의 경우 light chain variable region과 소수성 상호작용을 하는 부위이다. VHH의 경우는 light chain이 존재하지 않기 때문에 이 부분은 상대적으로 친수성 아미노산으로 치환되어 있다. 그러므로, 단일 도메인 항체의 특성을 유지하기 위해서는 인간화 시 VHH의 framework 2는 변형하지 않는다.
3) 신속 진단 키트 탐침자의 경우는 mouse Fc domain을 활용하기도 함
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update