| 세포가 만들어내는 나노입자인 세포밖소포체와 이를 활용한 코스메슈티컬 소재 개발 | |
|---|---|
| Date 2023-04-12 23:43:07 |
|

1. 세포밖소포체의 특징과 기능
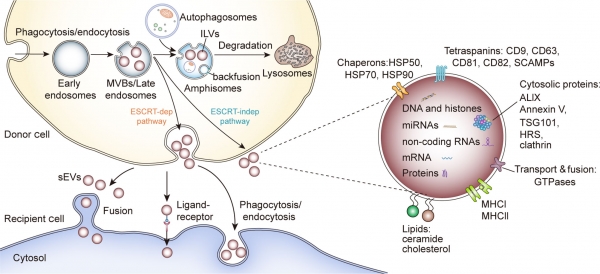
생명체 내에는 다양한 종류의 나노입자가 존재한다. 특히, 세포로부터 배출되고 막(membrane)으로 둘러싸인 나노입자인 세포밖소포체(Extracellular vesicle)에 대한 관심이 최근 폭발적으로 증가하고 있다. 세포밖소포체 혹은 세포외소포체는 생성 방식, 크기, 생화학적 구성 성분에 따라 엑소좀(exosome)과 미세소낭(microvesicle) 등 몇 가지로 분류되고 있다. 엑소좀은 이 중에서도 가장 작은 크기(50~150 nm)의 나노입자로, 2007년 스웨덴 Lötvall 교수 그룹에서 엑소좀이 부모 세포가 갖고 있는 mRNA와 microRNA와 같은 유전 정보를 담고 배출되어 생체 내에서 이동하여 다른 세포와 조직으로 이들을 전달할 수 있다는 것을 보고하면서, 엑소좀 연구 확장의 도화선이 되었다 [1]. 이러한 유전정보 전달을 통해 엑소좀은 다른 세포의 증식, 분화, 면역 반응 등을 조절할 수 있다는 연구 결과가 보고되고 있다. 그림 1에서와 같이, 엑소좀은 세포내에서 intracellular multivesicular body (MVB) 내의 intraluminal vesicle (ILV)이 세포막으로 배출이 되는 형태이다. 표면에는 세포막 단백질인 tetraspanin을 포함하며, 내부에는 세포질 단백질 등과 핵산 등이 분포하고 있다. 이들 구성 요소들은 지질 이중층으로 인해 외부 환경으로부터 보호를 받으면서, 인근 혹은 타 조직세포로 쉽게 endocytosis나 fusion 등의 방법으로 전달될 수 있다.
그림 1. 엑소좀 생성과 구성 요소, 그리고 세포 간 전달방법 [2].
이런 특징으로 인해 엑소좀을 포함한 세포밖소포체를 이용한 바이오의약품, 기능성 화장품, 건강기능식품 소재, 약물전달체 개발 연구가 활발히 진행되고 있다. 한편, 세포밖소포체는 암세포 등 질병 원인 세포가 보유한 특정 바이오마커를 포함하여 혈액을 통해 이동할 수 있으며, 혈액은 물론 소변, 침, 객담 등에 고농도로 존재하고 있다. 따라서 기존의조직생검을 통한 질병 진단이나 MRI 등의 영상 기반 진단법에 비해 편의성, 조기진단 가능성 등에서 유리한 액체생검(liquid biopsy)에서 요구되는 바이오마커 보고로서 세포밖소포체가 많이 연구되고 있다.
2. 세포밖소포체의 생산 및 분리 기술
1960년대 들어서면서 세포 이외에 작은 입자의 존재 가능성이 제기되었고, 이후 1987년 세포밖소포체의 존재가 규명되었음에도 불구하고 활발한 연구가 이뤄지지 않은 것은, 그 당시만 해도 이 나노입자의 기능에 대해 단순히 세포 내 불필요한 단백질을 배출해 내는 세포의 쓰레기봉투 정도로 인식된 이유가 있을 것이다. 이 외에도 세포밖소포체는 세포와는 달리 기술적으로 연구하는 것이 매우 난해하다는 이유도 있을 것이다. 즉, 세포밖소포체는 세포와 비교하여 매우 작아 일반적인 원심분리 방법으로는 용액 중 존재하는 세포밖소포체를 분리해 낼 수 없다. 또한, 일반 광학 현미경으로는 보이지 않아 전자현미경을 통해서만 관찰이 되기 때문에, 세포밖소포체를 연구하는 데에는 기술적 어려움이 있었다.
세포밖소포체를 코스메슈티컬로 개발하기 위해서는 균질한 품질의 세포밖소포체를 생산해야 한다. 세포밖소포체는 세포로부터 배출되는 여러 성분이 혼합된 복합 소재이기 때문에, 이들에 대한 품질 관리 여부는 이들이 상업용 제품으로서의 가치와 가능성이 있는지를 판가름할 수 있는 중요한 요소이다. 따라서 세포밖소포체 생산을 위한 세포 배양 공정은 단순히 세포밖소포체의 생산성 뿐만 아니라 균일한 품질의 세포밖소포체가 생산될 수 있도록 설계되어야 하고 평가되어야 할 것이다. 이후, 세포 배양액으로부터 회수된 세포밖소포체의 분리 및 정제 방법과 특성 분석 역시 균일한 세포밖소포체 생산을 통한 코스메슈티컬 소재 개발에 매우 중요하다고 사료된다.
근래에 polyethylene glycol (PEG)을 이용한 세포밖소포체의 침전 기반 제품들이 출시되어 많이 활용되고 있다. 이 방법은 간단하다는 강점은 있지만, 세포밖소포체 외에 단백질과 같은 불순물 등이 함께 분리되며, 잔존하는 PEG 제거 이슈가 있다. 초고속원심분리기를 이용한 세포밖소포체 분리 방법은 이러한 문제를 피할 수가 있지만, 분리 시간이 많이 소요되고, 기기 특성상 대용량 시료처리가 어렵고, 분리 과정 중 세포밖소포체의 손실이 크며, 과도한 원심분리로 인한 세포밖소포체의 물리적 손상이 발생할 수 있다. 항체 등을 이용한 immuno-affinity 기반 세포밖소포체를 분리하는 방법이 있지만, 항체와 결합된 세포밖소포체를 회수하는 것이 어렵기 때문에 진단 혹은 분석의 목적으로는 활용이 가능하지만, 치료용 세포밖소포체의 분리에는 적용하기가 어렵다. 최근 세포밖소포체가 고순도를 요구하는 의약 소재 등으로 연구되는 경우가 많아지면서, 단순 세포밖소포체의 분리를 넘어 고순도의 세포밖소포체를 회수할 수 있는 크로마토그래피 기반 정제 방법이 표준 방법으로 많이 활용되고 있다. 크기 배제 크로마토그래피(Size exclusion hromatography)는 용액 내 세포밖소포체를 크기 차이를 이용하여 다른 불순물들로부터 분리하여 정제하며, 타 방법과 비교하면 빠른시간 내에 고순도의 세포밖소포체를 손상 없이 회수할 수 있다는 강점이 있다. 다만, 시료의 부피가 크거나 정제 후 컬럼으로부터 용출되는 세포밖소포체가 희석될 수 있기 때문에, 한외여과(ultrafiltration)와 같은 농축 방법이 함께 동반되어야 한다. 따라서 세포밖소포체 분리 및 정제 방법은, 분리하고자 하는 목적, 시료의 종류, 부피 등에 따라 적합한 방법을 선택해야 하며, 시료 종류에 따라 수율 및 순도가 달라질 수 있기 때문에 최적화 과정을 거쳐야 한다. 분리 및 정제된 세포밖소포체의 크기 및 농도 측정은 일반적으로는 nanoparticle tracking analysis (NTA)를 많이 사용하는데, 이 방법의 경우 세포밖소포체와 유사한 크기의 단백질 응집체, lipoprotein 등을 구분해 낼 수 없으므로, 정제 후 용액 내 세포밖소포체의 수율 및 순도는 물리적 방법 외에 추가적으로 생화학적 방법 등을 통해 평가해야 한다. 국제 세포밖소포체 학회(International Society for Extracellular Vesicles, ISEV)에서는 생산된 나노입자가 세포밖소포체인지를 규명하는데 필요한 최소한의 가이드라인(Minimal Information for Studies of Extracellular Vesicles (MISEV) guideline)을 제시하고 있다. 이에 따르면, 세포밖소포체는 NTA 혹은 dynamic light scattering 등을 통한 크기 및 농도 분석, 전자현미경을 통한 morphology 관찰, 그리고 생화학적 방법으로는 세포밖소포체 표면과 내부에 있는 세포밖소포체 단백질 존재 유무와 추가적으로 세포밖소포체에는 없는 단백질에 대한 western blot 실험 등을 제안하고 있다. 따라서 세포밖소포체 개발자는 생산된 세포밖소포체에 대한 특성 분석을 통해 품질 관리에 필요한 자체적인 goal-post를 설정하고, 생산되는 배치(batch)마다 모니터링을 통해 균일한 품질을 유지할 수 있도록 해야 할 것이다.
3. 세포밖소포체 기반 코스메슈티컬 연구 및 개발 현황
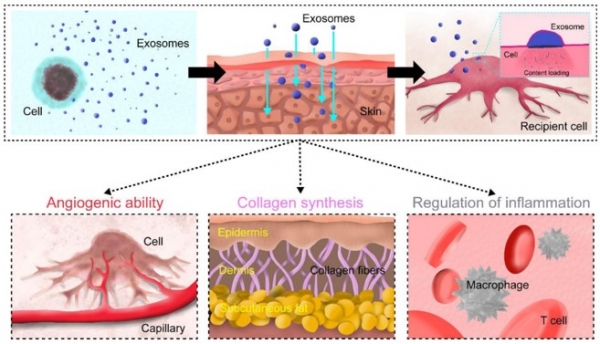
피부는 외부 자극으로부터 보호하기 위하여 표피, 진피 등으로 이루어져 있다. 이러한 구조로 인해 문제성 피부 개선을 위한 유효 성분 도포 시 투과성이 떨어지며, 효능의 한계를 가진다. 따라서 높은 투과성을 가지는 소재의 개발이 필요하며 이를 극복하기 위하여 나노입자를 활용하는 연구가 진행되고 있다. 이러한 나노-코스메슈티컬에서 유효 성분을 운반하는 나노 전달체로 주로 리포좀(liposome), 나노캡슐, 마이셀(micelle), dendrimer 등이 많이 사용되고 있으나, 화학 합성을 통해 제작된 나노입자들의 경우 항상 체내에서 독성과 부작용 발생의 가능성이 존재하므로, 이러한 이슈로부터 자유로운 신규 소재 개발이 필요하다. 이에 최근 생체 적합성이 높으면서 세포 투과성이 우수한 세포밖소포체 기반 코스메슈티컬이 많이 연구되고 있다. 미국 Exoceuticals사는 ZenBio와 라이센스 계약을 통해 피부재생, 염증 억제 목적으로 adipose stromal 세포 유래 세포밖소포체를 첨가한 모이스처라이져, 바디로션 등을 개발하여 판매하고 있다. 국내의 경우, ㈜엑소코바이오는 장미의 줄기세포 유래 세포밖소포체를 주성분으로 하여 인체지방세포배양액추출물 등을 포함한 미백, 주름 개선 기능성 화장품을 개발하였다. ㈜바이오솔루션은 인체지방줄기세포 유래 세포밖소포체를 화장품 원료화하여 피부재생, 보습 및 탈모 완화 효과를 확인하였고, ㈜지에프씨생명과학은 식물 줄기세포(캘러스) 유래 세포밖 소포체를 이용하여 피부 상처 치유 효과 및 피부 보습 유지 기능을 확인한 바가 있다. 또한, 웰에이징엑소바이오는 황칠나무 유래 세포밖소포체를 이용하여 미백용 화장품 소재로 개발하였다. 이렇듯, 세포밖소포체 기반 코스메슈티컬 소재는 세포밖소포체를 다양한 소스로부터 개발하는데, 우선 고등 세포와 미생물 배양 기반 생산 및 개발 사례부터 알아보면 다음과 같다.
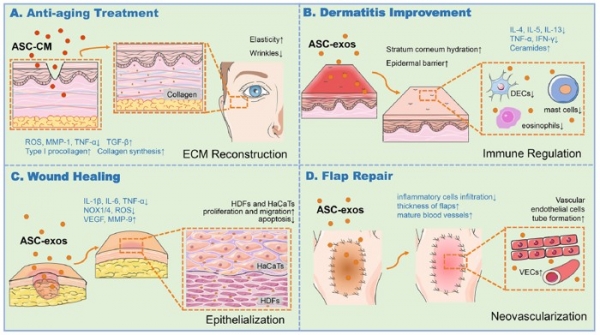
그림 4. 섬유아세포 유래 세포밖소포체를 이용한 염증 및 노화 치료 기술 [5] (Adapted with permission from Hu, S. et al . ACS nano 13, 11273-11282 (2019). Copyright 2023 American Chemical Society).
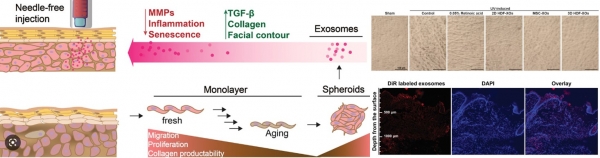
또한, 섬유아세포 유래 세포밖소포체를 이용한 피부 치료 기술 개발도 활발하게 진행되고 있다 (그림 4). 안면 윤곽개선 및 노화 억제를 위해 섬유아세포를 직접 자가 경피 주사하는 치료가 미국 FDA의 승인을 받았지만, 자가 섬유아세포의 품질이 사람마다 균일하지 않다는 단점이 있다. 이에 대안으로 spheroid로 3차원 배양한 섬유아세포 유래 세포밖 소포체를 needle-free injection을 통해 주입하는 연구가 진행된 바 있다. 섬유아세포 유래 세포밖소포체는 TNF-α (tumornecrosis factor α)의 하향 조절과 TGF-β (transforming growth factor β)의 상향 조절을 통해 프로콜라겐 I형 발현 증가와 MMP-1 발현의 감소를 유발하여 항염 및 항노화 효과가 있음이 보고되었다 [5].
3-2. 미생물 유래 세포밖소포체
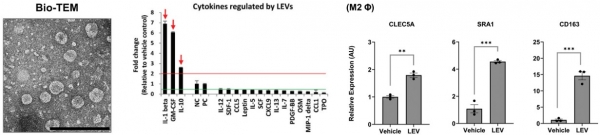
세포밖소포체는 포유동물세포는 물론, 박테리아, 조류, 식물세포 등 대부분의 세포에서 만들어질 수 있다. 아모레퍼시픽 기술연구원에서는 녹차 유산균(Lactobacillus plantarum APsulloc 331261) 유래 세포밖소포체가 피부의 과염증 상태를 개선하여 항염 효과를 나타냄을 확인하였다 (그림 5). 특히 녹차 유산균 유래 세포밖소포체를 통해 M2 대식세포와 관련된 세포 표면 마커 및 사이토카인의 발현을 유도함으로써 항염증성 M2 표현형으로의 분화를 촉진하였다. 특히,녹차 유산균 유래 세포밖소포체의 지질 대사체를 정량 분석한 결과 lysophosphatidylserine과 phosphatidylcholine이 풍부하여 인체 내로 기능성 물질을 흡수하는 지질 대사체로 구성됨을 보고하였다.
4. 식물 세포밖소포체를 이용한 코스메슈티컬 개발 전략
앞에서 기술한 줄기세포 유래 세포밖소포체 등의 코스메슈티컬 소재로서 발전 가능성에도 불구하고, 세포 배양을 통해 세포밖소포체를 생산해야 한다는 것은 많은 제약을 동반하게 된다. 첫 번째로 앞서 언급하였듯이 세포 배양을 통해 생산되는 세포밖소포체의 양이 많지 않으며, 소태아혈청 등과 같은 동물 유래 물질 사용이 제한되므로 무혈청 배양으로 인한 생산성 저하는 상업용 코스메슈티컬 생산에서 요구되는 생산 capacity를 충족하긴 어렵다. 이를 위해서는 항체 의약품 등 2세대 바이오의약품 생산과 같이 대규모 배양 설비와 기술이 필요하다. 하지만, BioProcess International 보고에 의하면, 현재 포유동물 세포 기반 글로벌 바이오의약품 생산 규모가 연간 총 11백만 리터이며, 따라서 이를 고려할 때 당장에 대용량의 세포밖소포체 전용 스케일업 설비 구축을 기대하기는 어려울 것으로 보인다.
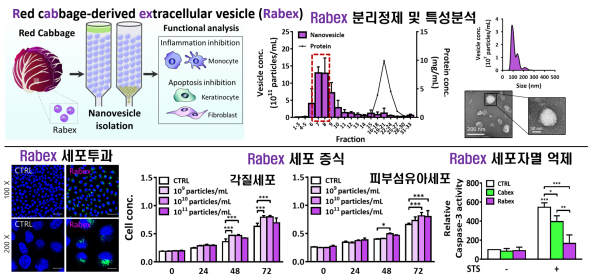
이런 이슈의 해결책으로 세포밖소포체 생산 원료를 다양화하는 전략이 필요하다. 최근 필자의 연구실을 포함하여 식물로부터 직접 세포밖소포체를 분리·정제하여 개발하는 연구들이 이뤄지고 있다. 식물 개체 내에는 이미 식물 내 세포들이 만들어낸 세포밖소포체들이 농축이 되어 있기 때문에, 적절한 방법으로 이들을 분리하여 정제하면 배양 과정 없이 세포밖소포체를 대량 생산할 수 있다. 생산성 문제 해결을 위한 대안 방법으로서의 의미 외에도 각 식물 세포밖소포체별 고유한 생물학적 기능이 있다는 강점이 있다. 예를 들면, 양배추(cabbage)와 적채(Red cabbage)로부터 한외여과와 크기 배제 크로마토그래피로 세포밖소포체를 분리할 수 있는데, 이들 세포밖소포체에 대한 기능 평가 결과, 포유동물 세포에 고효율로 투과되어 성분을 전달할 수 있으면서, 세포 독성이 낮고, 섬유아세포, 각질세포 등의 증식을 촉진시키면서 외부 스트레스로부터 세포를 보호하는 기능이 있다 (그림 6). 이들 복합 기능들은 코스메슈티컬 소재로서 필요한 기능들로서, 현재 이를 활용한 피부의 재생, 노화 방지용 코스메슈티컬로 개발되고 있다.
또한, 미백 효과를 목적으로 국내 자생하는 황칠나무 잎과 줄기에서 분리한 세포밖소포체를 이용한 연구 결과도 보고되었는데 (그림 7), 흑색종 세포주의 멜라닌 함량과 티로시나아제 활성 감소가 황칠나무 유래 세포밖소포체의 농도 의존적으로 나타나는 결과를 보고하였다 [8]. 이러한 연구 결과를 토대로 황칠나무 세포밖소포체 고보습 미백 주름 기능성 크림을 제조하여 판매하고 있다.
그림 6. 식물 유래 세포밖소포체를 이용한 코스메슈티컬 소재 개발 연구 예. 적채 유래 세포밖소포체(Rabex)를 활용하여 피부 세포의
투과성, 증식 촉진, 스트레스 유발 세포자멸 억제 등의 기능 평가 [7].
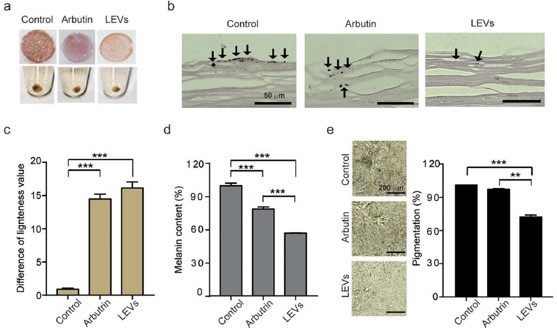
그림 7. 황칠나무 유래 세포밖소포체를 이용한 미백 기능성 화장품 개발 사례 [8].
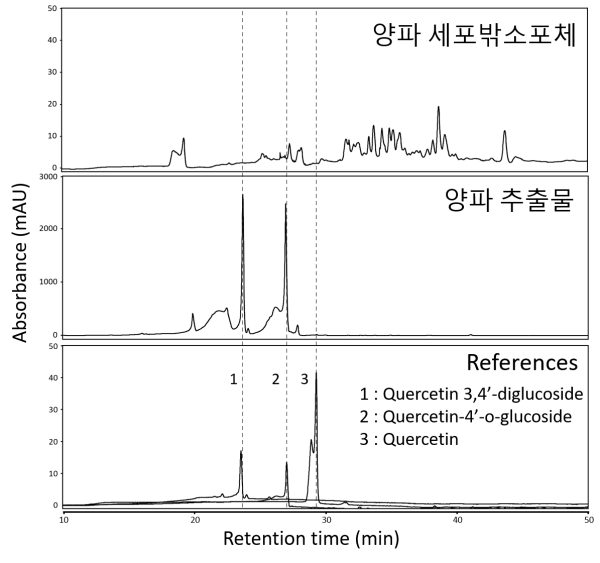
그림 8. 양파 세포밖소포체와 추출물 주요 성분 비교 분석. 양파로부터 정제된 세포밖소포체(위)와 추출물(중간), 그리고 reference로 사용된 Quecetin과 그 유도체에 대한 HPLC 분석 결과 [9].
양파 유래 세포밖소포체는 마크로파지의 염증 반응을 제어하는 기능이 있어, 염증을 동반하는 피부질환 치료용 코스메슈티컬 소재로 개발이 가능하다. 흥미로운 것은, 이러한 식물 세포밖소포체가 보유한 성분들이 기존에 알려진 식물 추출물과는 다르다는 것이다. 대표적인 양파 추출물인 Quercetin 유도체들은 강력한 항염 기능이 있는 것으로 알려져 있다.
하지만, 양파 세포밖소포체의 내에는 이들 Quercetin 유도체들이 거의 검출되지 않았으며, 상대적으로 소수성이 높은 성분들이 검출되었다 (그림 8). 세포밖소포체의 경우, 추출물과는 달리 복합성분들을 보유하고 있으며, 저분자 물질과 펩타이드는 물론, 단백질, 핵산, 지질 등 다양한 성분들이 복합적으로 탑재되어 있다. 뿐만 아니라, 소수성 성분들은 주로 세포밖소포체의 막에 존재할 수 있으며, 친수성 성분들은 내부에 존재할 수 있기 때문에 다양한 성질을 가지고 있는 성분들을 탑재할 수 있다. 이러한 성분들이 지질 이중층 내에서 보호를 받으면서 세포를 쉽게 투과할 수 있는 강점이 있기 때문에 식물 세포밖소포체는 코스메슈티컬로서의 개발 가치가 매우 높다고 사료된다.
5. 세포밖소포체의 엔지니어링과 코스메슈티컬로서의 활용 전략
앞서 기술한 바와 같이, 세포밖소포체는 부모세포로부터 받은 단백질, 펩타이드, 핵산, 지질, 대사체 등을 포함할 수 있기 때문에, 이들이 보유한 특별 기능을 활용하여 코스메슈티컬 소재로 개발할 수 있다. 하지만, 모든 세포밖소포체가 우리가 필요로 하는 기능을 보유하고 있지 않으며, 있다 하더라도 그 기능의 유효성이 떨어질 수 있으며, 세포 배양을 통해 생산되는 세포밖소포체의 생산성 역시 낮아 높은 용량으로 처리하기가 어렵다는 이슈가 있다. 따라서 이를 극복할 수 있는 방안으로는 세포밖소포체를 엔지니어링 하여 코스메슈티컬 소재의 기능을 강화하는 기술을 적용할 수 있다.
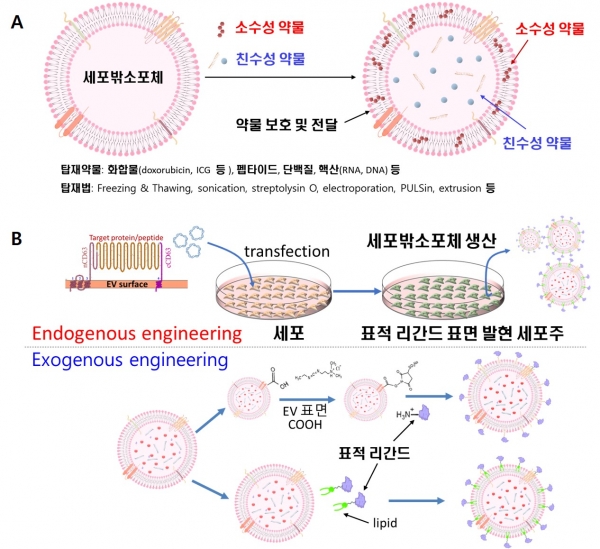
세포밖소포체는 부피 대비 넓은 표면적으로 인해 외부에서도 새로운 기능성 물질을 추가로 다량 탑재할 수 있다. 따라서 원세포밖소포체의 약한 기능성을 강화하기 위해 화합물, 핵산, 단백질, 펩타이드 등의 약물 탑재된 세포밖소포체를 제작할 수 있다. 세포밖소포체 내 약물 탑재 방법은 탑재하고자 하는 약물의 종류 및 성질 등에 의해 달라질 수 있다.
그림 9. 세포밖소포체 엔지니어링 종류. A: 세포밖소포체 내 기능성 약물 탑재를 통한 생물학적 기능 부여. B: 세포밖소포체의 특정 세포 및 조직 표적화를 위한 표면 엔지니어링 종류. 세포밖소포체 엔지니어링을 통해 유효성 및 표적성이 강화된 코스메슈티컬 소재로 개발 가능.
일반적으로 소수성 약물의 경우 세포밖소포체 표면 지질층에 쉽게 삽입될 수 있다. 소수성 약물의 경우에는세포밖소포체 내부로 탑재를 해야 하는데, 핵산의 경우에는electroporation 등을 활용할 수 있으며, 그 외에도 freezing &thawing, sonication, streptolysin O 기반 pore 형성법, PULSin 등을 이용한 방법이 있으며, 최근 일정 크기의 막을 통과 하면서 발생되는 압력에 의해 세포밖소포체 내 약물을 탑재하거나 약물 탑재된 지질나노입자와 융합하는 extrusion 방법도 활용되고 있다.
세포밖소포체의 표면에는 지질은 물론 세포 유래 단백질로 구성되어 있어서, 이를 활용하여 특정 세포 및 조직을 표적할 수 있는 리간드를 결합시킬 수 있다. 세포밖소포체 표면 엔지니어링은 크게 endogenous와 exogenous 엔지니어링 으로 분류할 수 있다. 전자의 경우, 세포의 유전적 형질을 변환하여 세포의 표면에 표적 리간드가 발현되게 만들면, 이세포가 만들어내는 세포밖소포체 역시 표적 리간드가 발현된다는 원리를 활용한 것이다. 표적 리간드 고발현 세포주를 제작해야 하는 기술적 어려움이 있지만, 제작 후에는 배양을 통해 쉽게 표적 기능이 있는 세포밖소포체를 생산할 수 있다는 강점이 있다. Exogenous 엔지니어링의 경우, 이미 생산된 세포밖소포체의 표면에 있는 단백질 말단에 화학 반응 등을 통해 표적 리간드를 결합시키는 방법이다. 최근 화학적 반응을 회피하기 위해 표적 리간드를 지질과 미리 화학 결합시킨 후, 세포밖소포체에 첨가하여 지질이 세포밖소포체 막에 자연스레 삽입되는 원리를 이용한 방법도 사용되고 있다. 이 방법들은 비교적 짧은 시간에 다양한 표적 리간드를 평가할 수 있다는 강점이 있지만, 화학 및 물리적 결합 반응 중에 발생하는 세포밖소포체의 변형 또는 손실이 크며, 반응 배치마다 균일한 세포밖소포체를 생산하는 것이 어렵다는 약점이 있다. 따라서 코스메슈티컬로 개발하고자 하는 세포밖소포체의 종류와 목적에 맞춰 약물 탑재와 표면 엔지니어링 방법을 선택해야 하며, 제작된 세포밖소포체에 대한 특성 분석을 통해 기능성은 물론 안전성과 균일성에 대한 평가가 동반되어야 할 것이다.
6. 맺음말
앞서 기술한 바와 같이, 코스메슈티컬 소재로서 세포밖소포체가 보유한 강점들을 정리해 보면, 1) 세포 유래 물질로 높은 생체적합성 2) 단백질, 핵산, 대사체 등 다양한 기능성 성분 포함 3) 지질이중층에 인한 안정성 4) 높은 세포 투과력 등이 있다. 이러한 성질은 코스메슈티컬로 개발되는 저분자 화합물이나 합성 나노입자 기반 약물 전달체에 비해 분명 큰 장점으로 사료된다. 하지만, 성공적인 세포밖소포체 기반 코스메슈티컬이 개발되기 위해서는 넘어야 할 장벽도 높다. 개발 역사가 상대적으로 짧고 사례가 부족하므로, 단순 화장품이 아닌 코스메슈티컬로서 인정받기 위한 식약처의 세포밖소포체 전담 관리 시스템이 필요하며, 명확한 가이드라인에 따라 개발자들이 세포밖소포체 품질 및 안전성 평가등을 수행할 수 있는 여건이 조성되어야 한다. 세포치료제와는 달리 세포 분비물인 세포밖소포체 개발 및 임상을 전담 할 수 있는 관리 당국의 전문 인력 및 규정이 필요할 것이다. 개발자 입장에서는 이들의 품질 유지 및 관리를 위해, 품질관리에 필요한 세포밖소포체 마커를 발굴하고 이들에 대한 모니터링을 통해 균일한 약품을 생산해야 한다. 이와 같은 제도와 기술적 발전을 통해 세포밖소포체는 새로운 코스메슈티컬 소재로서 시장의 다양성을 확보할 수 있을 것으로 예상되며, 초고령사회 진입 후 예상되는 웰빙에 대한 니즈 충족에 기여할 것을 고대하며 글을 마무리하고자 한다.
참고문헌
[1] Valadi, H. et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature cell biology 9, 654-659 (2007).
[2] Gao, Y. et al. Small Extracellular Vesicles: A Novel Avenue for Cancer Management. Frontiers in oncology 11, 638357 (2021).
[3] Yang, G. H. et al. Overcome the barriers of the skin: exosome therapy. Biomaterials research 25, 22 (2021).
[4] Xiong, M. et al. Exosomes From Adipose-Derived Stem Cells: The Emerging Roles and Applications in Tissue Regeneration of Plastic and Cosmetic Surgery. Frontiers in cell and developmental biology 8, 574223 (2020).
[5] Hu, S. et al. Needle-Free Injection of Exosomes Derived from Human Dermal Fibroblast Spheroids Ameliorates Skin Photoaging. ACS nano 13, 11273-11282 (2019).
[6] Kim, W. et al. Lactobacillus plantarum-derived extracellular vesicles induce anti-inflammatory M2 macrophage polarization in vitro. Journal of extracellular vesicles 9, 1793514 (2020).
[7] You, J. Y., Kang, S. J. & Rhee, W. J. Isolation of cabbage exosome-like nanovesicles and investigation of their biological activities in human cells. Bioactive materials 6, 4321-4332 (2021).
[8] Lee, R. et al. Anti-melanogenic effects of extracellular vesicles derived from plant leaves and stems in mouse melanoma cells and human healthy skin. Journal of extracellular vesicles 9, 1703480 (2020).
[9] Kang, S. J., Kim, S. E., Seo, M.-J., Kim, E. & Rhee, W. J. Suppression of inflammatory responses in macrophages by onionderived extracellular vesicles. Journal of Industrial and Engineering Chemistry 115, 287-297 (2022).
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update