| 3차원 세포배양을 위한 바이오잉크 개발 | |
|---|---|
| Date 2022-09-26 15:42:20 |
|

1. 서론
적층 제조 공정의 일종인 3차원 프린팅(3D printing)은 자연 조직과 같은 복잡한 구조체 제작을 가능케 함으로써 생물학적으로 유사한 세포지지체를 모사하는 기술의 영역까지 발전하고 있다. 세포 및 생리활성 물질의 포집이 가능한 생체재료(bioink)의 개발은 조직공학 및 재생의약, 약물 스크리닝 등의 다양한 분야에서 활용될 수 있으며 3D ‘bio’ printing 분야가 생겨나게 하였다.
세포외기질(extracellular matrix, ECM)과 세포 간의 상호작용, 그리고 세포의 거동(cell morphology)이 차원(dimension)에 따라 달리 나타난다는 것은 이미 선행연구로 많은 조사가 되어왔다. 약물 독성 평가에 활용되는 질병 모델 또는 암세포 연구에서 2D와 3D에서의 세포의 분화, 증식 및 기능의 차이가 밝혀진 바 있으며, 주요한 미세환경 특성이 2차원 세포 배양 시스템에서는 구현되지 않는 한계는 3D 환경에서의 세포배양이 중요함을 인지하는 계기가 되었다. 인공피부 및 인공각막을 활용한 대체시험법 연구를 향한 움직임이 시작된 지 오래이며, 의약품, 천연물, 화학물질 등의 생리학적 작용과 약리효능을 평가하기 위한 in vitro 3D 모델이 제시되기 시작하였다. 이제 배양뿐만 아니라 분석을 위한 기반 소재의 선택이 중요하게 인지되고 있는 듯 하다.
본 글에서는 3D (bio)prining 의 세부 기술 중에서도 바이오잉크(bioink) 소재를 중심으로 소개하고자 한다.
2. 본론
2.1. 3D (바이오)프린팅
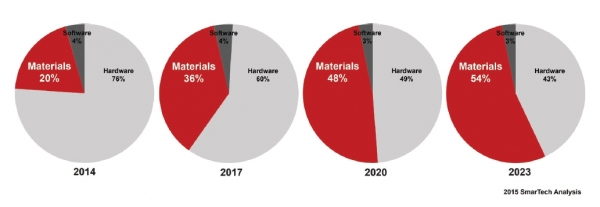
3D printing의 주요 기술 분야는 3D 프린터 (하드웨어), 프로그래밍 소프트웨어, 그리고 바이오잉크로 분류될 수 있다. 하드웨어 및 소프트웨어는 관련 특허의 만료와 오픈소스 허브가 등장함에 따라 차별화된 기술 개발의 속도가 정체되어 있는 상태이다. 반면, 프린팅에 활용될 소재들의 다양화에 대한 수요가 꾸준히 증가함에 따라 목적 세포의 특성에 맞는 소재 개발 영역은 더욱 중요해지고 있다 (Fig. 1) [2].
현재까지 3D printing 잉크로 사용되고 있는 주소재 중 무기물로서는 금속, 세라믹이 있으며, 유기물로서는 합성고분자 또는 천연고분자를 예로 들 수 있다. 우수한 물리적 강도를 가지는 금속과 세라믹은 의족 및 의수와 같은 단단한 경조직의 보철물 제작에 활용되고 있는 반면에 피부와 연골과 같은 연조직을 대체할 수 있는 소재로서는 합성고분자 또는 천연고분자가 이용되고 있다. 또한 고분자 소재는 세포가 감당할 수 있는 수준의 온도에서 프린팅이 가능한 경우가 있기에 세포 및 세포 성장에 필요한 인자들을 소재에 혼합할 수 있다는 장점을 지니고 있어 바이오잉크(bioink)로서의 활용도가 높다. 특히 합성고분자를 활용한 소재 연구가 많은데 현재까지 알려진 합성고분자들은 물리화학적 물성 조절이 용이한 polycaprolactone(PCL), polyethylene glycol(PEG), polylactic acid(PLA), polypropylene fumarate(PPF)를 들 수 있다 [3]. 천연고분자의 경우, 단백질 소재로서 콜라젠(collagen), 젤라틴(gelatin), 실크(silk)가 있으며, 당소재로 알긴산(alginate), 히알루론산(hyaluronic aicd), 키토산(chitosan)이 있다. 이와 더불어, 탈세포화된 세포외 기질(decellularized extracellular matrix, dECM)이 활용되기도 한다.
합성고분자는 주로 고온이나 유기용매에 녹여 출력하는 방식이 대부분이나 세포를 포집한 상태로 다양한 가교법을 이용하여 이를 회피할 수 있다. 가공성이 우수하고 기계적 물성이 좋다는 장점도 지닌다. 반응기를 지니는 합성 고분자의 경우, 다양한 분자적 변형을 통하여 물성 조절이 용이하다. RGD(Arg-Gly-Asp), YIGSR(Tyr-Ile-Gly-Ser-Arg),IKVAV(Ile-Lys-Val-Ala-Val)와 같은 생리활성 펩타이드와의 결합 또는 천연고분자들과 함께 사용하여 생체적합성 및 세포친화성을 높이기도 한다 [4].
천연고분자는 자연에서 대량 얻을 수 있으며, 생체적합성 및 세포친화성이 좋다는 큰 장점이 있다. 상대적으로 낮은점탄성 및 기계적 물성으로 인하여 적층성의 한계를 보이기도 하지만 다양한 분자 수준의 물리적, 화학적 가교법(calcium mediated gelation, methacryloyl
photocrosslinking, norbornene photo-click chemistry, dityrosine crosslinking, etc.)이 개발되면서 고유의 생리활성을 유지하면서도 기계적 물성을 향상시키는 연구들이 수행되고 있다 [5].
3D 세포 배양시, 지지체 기질 재료로 가장 많이 활용되고 있는 마트리겔(matrigel)이라는 소재가 있다. 쥐의 육종세포에서 추출한 천연고분자(콜라겐) 기반의 재료로 약 1,500가지 이상의 규명되지 않은 다양한 구성성분을 포함한 복합체이다. 하지만, 3D printing에 적용될 수 있는 인쇄적성(printability)을 가지고 있지는 않아 원하는 3차원 구조 형성에는어려움이 있다. 이렇듯, 바이오잉크로 활용되기 위해서는 몇 가지 요구조건이 존재한다. 겔화(gelation) 및 가교능(crosslinking ability), 형상유지(shape fidelity) 및 점탄성(viscoelasticity)이 인쇄적성(printability)을 좌우할 수 있는 특성에 해당되며, 특히, 바이오잉크의 전단감소 특성(shear thinning properties)은 압출방식
(extrusion) 기반의 프린터에서 출력시 야기되는 전단 응력(shear stress)에 대한 세포손상을 줄여줄 수 있는 특성이다 [6]. 전단감소 특성은 80-90% 이상의 세포의 생존능을 가능하게 하며, 노즐의 막힘 현상을 방지함으로써 높은 해상도 및 용이한 인쇄성 조절에 기여할 수 있다 [7]. 이렇듯, 다양한 바이오 소재가 있어도 3D 바이오잉크 소재로서 ‘활용’되기에는 많은 특성이 요구되며, 이는 출력 후 구조물의 물리적 안정성, 기계적 물성, 생분해성 등의 요건에도 영향을 주어 조직 재생 및 유지를 변화시키기도 한다.
3D 바이오잉크는 소재의 선택과 실험 디자인에 따라 출력되는 구조체의 경도 (stiffness modulus)를 조절할 수 있어조직에 유사한 기계적 물성(mechanical properties) 모사가 가능하다 [8]. 또한 세포마다 선호하는 표면 경도를 모사하고,3D 구조체의 네트워크 조절로 물질이동의 확산을 제어할 수도 있어 특정 세포의 생육에도 도움을 줄 수 있다. 이렇듯,바이오잉크 소재의 다양화는 기존의 인쇄적성 및 세포의 생존력을 향상시키는 것에서 국한되는 것이 아닌 다양한 조직 내 구조와 물성을 모방할 수 있는 전략이기도 하다. 궁극적으로는, 개인 또는 조직 맞춤형 구조체를 제공할 수 있어서 노화, 질병 및 인종에 따라 달라지는 조직의 물리적, 기계적, 생물학적 물성의 차이를 구현할 수 있는 지지체로 개발될수 있다. 언젠가 본 기술이 숙성되면 항체의약품, 세포 치료제, 세포 배양 의약품, 유전자 치료제 등 다수의 다양한 유형의 바이오의약품이 3차원 지지체를 기반으로 생산될 수 있을 것이며, 의약품질 및 생산성 향상에도 기여할 수 있을 것으로 예상되고 있다.
2.2. 상용화 및 바이오잉크 소재 개발 사례
살아있는 세포를 담지할 수 있는 바이오잉크에 대한 소재와 이를 기반으로 하는 3D 바이오프린팅 기술 개발이 활발히 진행됨에 따라 많은 연구들이 실제 임상학적으로 실현되어오고 있다. 많은 임상 사례가 보고된 바 있으나, 최근 2022년 미국에서는 환자 본인의 세포와 콜라겐 기반의 바이오잉크(3D Bio Therapeutics 社)를 혼합하여 제작된 귀 이식재건술이 수행되었다. 목적 조직의 세포에 특이적인 바이오잉크 소재를 개발하고 이식 가능한 구조체로 전환하여, 임상재건으로 직결될 수 있음을 시사하는 사례이다.
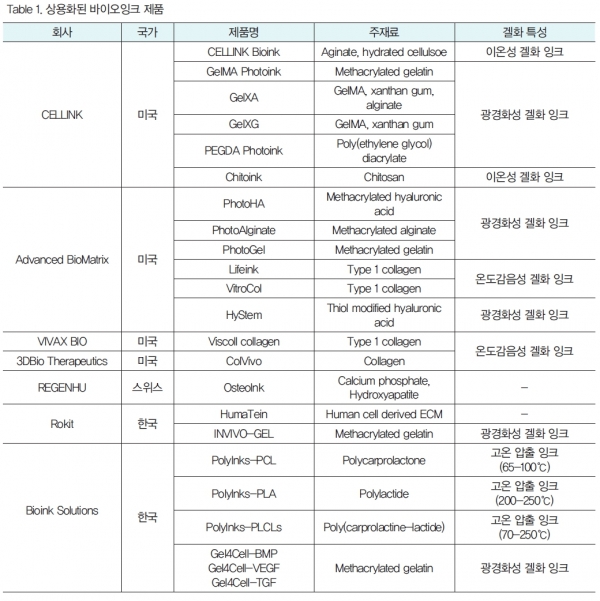
바이오잉크의 상용화는 국내·외에서 점진적으로 증가하는 추세이다 (Table 1). 3D 바이오프린팅 시장에서의 점유율이 가장 높은 국가는 미국이며, 2007년 창립된 미국의 Organovo와 스위스의 REGENHU를 시작으로, VIVAX BIO(2013년 설립), Allevi(2014년 설립), CELLINK(2016년 설립)의 세 기업 모두 미국을 본사로 하여 큰 기업 규모로 성장하였다.
초기 바이오프린팅 시장에서는 대부분의 기업들이 주로 바이오프린터 하드웨어 기술개발에 중점을 두며 기업 규모를 확장하였다. 그러나, 그중에서도 CELLINK는 하드웨어 기술 개발과 더불어 바이오잉크 소재 개발에서 또한 큰 두각을 나타내었다.
CELLINK에서는 CELLINK Bioink(alginate 유래), GelMA Photoink(gelatin 유래), Chitoink(chitosan 유래) 등의 다양한 종류의 천연고분자를 주원료로 사용하여 광개시제, 인산칼슘, 세포부착 촉진 펩타이드(RGD), 성장인자 등이 포함된 뼈, 연골, 피부 재생 유도성 및 세포 배양 지지체용 바이오잉크를 개발하였다. 2021년에는 세포 배양 지지체 소재 개발 기업인 Advanced BioMatrix(2008년 설립)를 인수하였다. Advanced BioMatrix는 다양한 종류의 collagen(atelocollagen,telocollagen, insoluble collagen)기반의 하이드로겔을 개발한 바 있고, 이의 연장선으로 Type 1 collagen 기반의 Lifeink를 개발하였다. 후속으로 PhotoAlginate (methacrylated alginate),
PhotoHA (methacrylated hyaluronic acid), PhotoGel(methacrylated gelatin)등의 광경화성 바이오잉크를 출시한 바 있다.
한국은 2012년 창립된 Rokit의 primary human cell-derived ECM 기반의 HumaTein과 광경화성 젤라틴(GelMA) 기반의 INVIVO-GEL이 있다. 또 다른 기업인 Bioink Solutions(2020년 설립)에서는 광경화성 젤라틴 기반의 잉크와 더불어,구조체의 생분해속도가 조절 가능한 PCL, PLA 고분자 기반의 잉크를 출시한 바 있다.
이외에도 아직까지 상용화 단계는 아니지만, 기존에 보고되지 않은 바이오잉크 발견과 응용에 대한 개발이 국내·외 에서 활발히 수행되고 있다. 포항공과대학 차형준 교수 연구팀은 말미잘 유래 실크 단백질을 기반으로 한 광경화성 바이오잉크를 개발하였다 [9]. 아미노산 기반의 광가교가 가능하여 높은 정확도의 인쇄적성(printability)을 지니고, 출력된구조체의 우수한 기계적 물성(0.85 MPa)과 더불어 향상된 연골형성(chondrogenesis) 및 뼈형성(osteogenesis)을 증명함으로서 연골 또는 골 대체 프린팅 소재로 사용될 수 있음을 보여주었다. 미국 UCLA 대학 Nasim Annabi 교수 연구팀은 광경화성 재조합 인간 엘라스틴을 기반으로 한 탄성 바이오잉크를 개발하였다. GelMA와 함께 복합 소재화 하여 다양한 종류의 조직 특이적 세포(cardiomyocytes, cardiac fibroblasts, human umbilical vein endothelial cells)가 담지된 복잡한 구조의 혈관화된 심장 조직을 구현하였다. 이는 심장의 내피 장벽 기능과 자발적 박동의 기능성을 검증함으로 심장 대체 소재로의 사용 가능성을 보여준 연구이기도 하다 [10]. 이렇듯 자연에 존재하는 고분자를 생합성하여 바이오잉크로 개발하려는 새로운 연구 방향이 제시되고 있다.
3. 맺음말
바이오프린팅 기술은 지속적인 기술 및 소재의 개량 및 제조 공정 확립 등이 필요한 분야이며, 나아가 전임상, 임상연구를 아우르는 융합학문이다. 조직공학, 생물공학, 기계공학, 재료공학 및 의공학이 총 망라된 기술이라 할 수 있다.
살아있는 세포를 담지할 수 있는 잉크 소재를 개발하는 연구나 프린팅 가능한 소재로 구조체를 형성 후 세포를 코팅하여 환경을 모사하는
3D 배양 연구들이 활발히 진행되고 있으며, 이에 필요한 소재의 다양성을 확립하는 일이 앞으로 더욱 중요해질 핵심 기술임을 알 수 있다. 제조 공정의 재현성을 확립할 수 있는 잉크 소재의 개발은 기계적, 화학적, 생물학적 세포 신호의 미세조절의 가능성을 보여주며, 이는 목적하는 특정 세포의 생산과 적용에 확대될 수 있는 핵심 기술임을 확인하였다. 바이오잉크의 지속적인 개발은 in vitro 세포 생산, 동물실험 대체 기반소재, 인공조직 대체제 등과 같은 분야에 활발히 적용될 수 있을 것으로 기대한다.
참고문헌
[1] SmarTech Analysis (2015) 3D printing in medical markets 2015: An opportunity analysis and ten-year forecast.
[2] J. Gopinathan, and I. Noh (2018) Recent trends in bioinks for 3D printing. Biomater. Res. 22: 11.
[3] S.H. Moon, H.N. Choi, and Y.J. Yang (2022) Natural/synthetic polymer materials for bioink development. Biotechnol. Bioprocess Eng. https://doi.org/10.1007/s12257-021-0418-1.
[4] W. Dai, J. Belt, and W.M. Saltzman (1994) Cell-binding peptides conjugated to poly(ethylene glycol) promote neural cell aggregation. Biotechnology. (N. Y). 12: 797–801.
[5] A. GhavamiNejad, N. Ashammakhi, X.Y. Wu, and A. Khademhosseini (2020) Crosslinking strategies for 3D bioprinting of polymeric hydrogels. Small. 16: 2002931.
[6] J. Malda,. J. Visser. , : F.P. Melchels. , T. Jüüngst, W.E. Hennink, W.J.A. Dhert, J. Groll, and D.W. Hutmacher (2013) 25th anniversary article: Engineering hydrogels for biofabrication. Adv. Mater. 25: 5011–5028.
[7] Y. Wu, A. Wenger, H. Golzar, and X. (Shirley) Tang (2020) 3D bioprinting of bicellular liver lobule-mimetic structures via microextrusion of cellulose nanocrystal-incorporated shear-thinning bioink. Sci. Rep. 10: 20648
[8] M.D.A. Norman, S.A. Ferreira, G.M. Jowett, L. Bozec, and E. Gentleman (2021) Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nat. Protoc. 16: 2418–2449.
[9] T.Y. Park, Y.J. Yang, D.-H. Ha, D.-W. Cho, and H.J. Cha (2019) Marine-derived natural polymer-based bioprinting ink for biocompatible, durable, and controllable 3D constructs. Biofabrication. 11: 035001–035001.
[10] S. Lee, E.S. Sani, A.R. Spencer, Y. Guan, A.S. Weiss, and N. Annabi (2020) Human-recombinant-elastin-based bioinks for 3D bioprinting of vascularized soft tissues. Adv. Mater. 32: 2003915.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update