| 3차원 세포배양 시스템의 종류와 활용 | |
|---|---|
| Date 2022-09-26 15:28:02 |
|

대웅제약 바이오공정센터
skmin@daewoong.co.kr
1. 서론
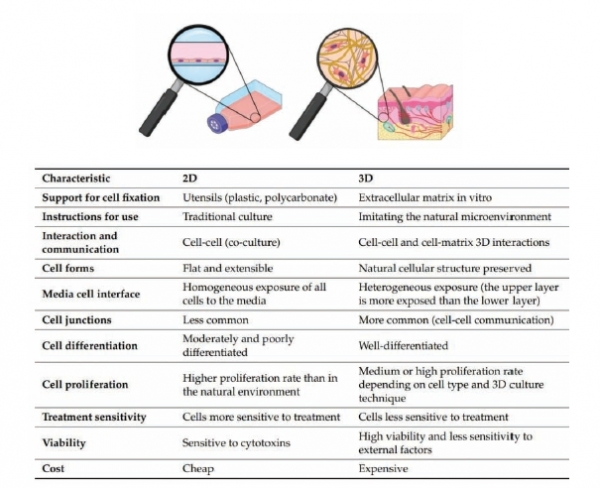
우리 몸을 구성하는 세포들은 다양한 미세환경에서 존재하고 있다. 흐르는 액체나기체를 맞대고 있기도 하며 물리적 자극을 지속적으로 받기도 하고 조직을 이루는 동종의 세포 혹은 이종의 세포와 상호 작용을 하며 조직 고유의 특성을 나타낸다. 이러한 세포의 특성을 이해하고 있음에도 불구하고 동물세포배양을 이용한 기초과학 연구와 독성분석, 질병모델개발, 약물효능평가 등의 의약학 연구를 포함한 다양한 생명공학분야의 연구에서 여전히 플라스틱 접시를 이용한 전통적인 세포배양 방법을 익숙하게 사용하고 있다. 비다공성 접시의 한쪽 면에 붙어서 자라는 2차원(2-dimensional, 2D) 세포배양은 미세한 환경변화를 반영할 수가 없으며 동적인 특성 또한 관찰할 수가 없는 반면, 3차원 (3-dimensional, 3D) 세포배양은 조직의 형태와 주변 환경을 유사하게 제공할 수 있어 세포 고유의 특성을 반영할 수 있다.
(그림 1, [1,2]).3D 미세환경에서 배양된 세포는 모든 방향에서 주변환경과 상호작용을 하며 세포의 형태, 성장, 증식에서 유전자/단백질 발현, 신호전달에 이르기까지 고유의 생리학적 특성을 나타낸다. 본 기고문에서는 이러한 3D 세포배양의 종류와 특징을 소개하고 의약품 개발에 있어서 활용분야, 기술의 한계점 및 극복하여야 할 과제에 대해 이야기하고자 한다.
2. 3차원 세포배양 기술
3D 세포배양의 중요성은 1980년대 초반 생체 내 성격을 그대로 가지는 유방암 조직의 개발을 통해 세포외기질 (Extracellular matrix,
ECM)과 유사한 3D 배양 환경의 필요성으로 시작되었다. 그 이후 1988년도 전기방사 기술로 제작된 나노섬유에섬유아세포, 암세포 등을 최초로 배양하여 인공조직에 대한 개념을 인식하기 시작한 이래로 다양한 소재를 이용한 기술발전이 지속 되었다.
3D 세포배양은 세포가 주변 환경과 모든 방향으로 상호작용하는 기본개념을 포함하는데, 이를 위해서는 조직 내 구조와 유사하게 인위적으로 만든 Scaffold를 제공하기도 하고 세포들 스스로 뭉치게 하여 주변세포와의 상호작용을 하며 조직화하도록 유도할 수도 있다. 이러한 차이에 의해 크게 Scaffold-based 방식과 Scaffold-free 방식으로 나뉘게 된다 [3-5].
Scaffold-based 방식은 세포배양의 지지체로 하이드로겔 또는 나노섬유 구조의 scaffold를 제공하며 세포 ECM의 형태와 유사한 다공성의 구조이므로 산소, 영양분, 노폐물 등의 교환이 원활히 이루어진다. 친수성의 하이드로겔은 다량의 수분을 함유할 수 있어 수용성 성장인자나 호르몬을 포함할 수 있다. 세포와 혼재된 상태로 plating되었을 때 세포들자체적으로 신호분자를 방출하여 이동하거나 주변 환경을 재구성해서 스스로 그 기능을 나타내며 자라게 돕는다. 폴리에틸렌글리콜 (poly(ethylene glycol), PEG), 폴리비닐알콜 (poly(vinyl alcohol),
PVA), 폴리하이드록시에틸메타아크릴레이트 (poly(2-hydroxyethyl methacrylate), pHEMA) 등의 합성 고분자와 콜라겐, 히알루론산, 알지네이트, 젤라틴 등의 천연 고분자를 사용하여 제작이 가능하며 실제 ECM과 생화학적, 물리화학적 특성이 매우 유사하여 생분해성이 높기때문에 체내에서 서서히 분해되며 실제 ECM으로 교체될 수 있다. 그 밖에도 나노섬유 scaffold는 주로 전기방사 방법으로 제작하며 의료용 고분자인 폴리카프로락톤 (polycaplo lacton, PCL), 폴리(락틱-co-글리콜산) (poly(lactide-coglycolide,PLGA), 폴리에틸렌옥사이드 (polyethylene oxide, PEO) 등과 알지네이트, 셀룰로오스 등을 사용한다. ECM과 형태적으로 매우 유사하여 기초연구를 위한 in vitro 세포배양 시스템 구축에 유용하게 활용될 뿐만 아니라 물리적으로 단단한 ECM으로 구성된 조직인 뼈, 연골, 인대, 혈관, 피부 등을 모사하기에 적합하다. 합성 고분자는 물리 · 화학적 특성을 변경할 수 있기 때문에 물성 조절, 표면활성 변화를 통해 세포 배양 최적화를 할 수 있는 반면 생체적합성이 비교적 낮은 단점이 있기 때문에 이것을 극복하기 위해 최근에는 천연 고분자와 혼합하여 제작한 지지체를 세포배양에 사용하는 다양한 연구들이 보고되고 있다.
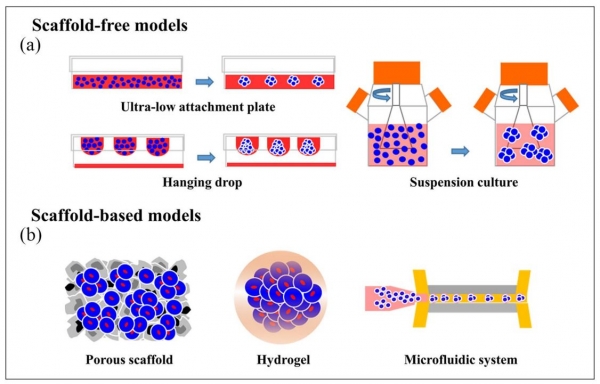
Scaffold-free 방식은 세포가 부착할 표면을 제공하지 않아 세포들끼리 뭉쳐서 구형의 3D spheroid를 형성하는 방식이다 (그림 2, [6]).
Ultra-low attachment coating이 된 플레이트를 이용하여 형성하거나 플레이트 표면에 배지 방울을 거꾸로 매달아 세포가 배지 내 아래쪽으로 모이게 하여 spheroid를 형성하는 Hanging drop 방식이 있으며, spheroid의 크기는 목적에 따라 세포 seeding 양이나 drop
volume을 이용해서 조절할 수 있다. 현재는 spheroid를 고속대량처리 방식(High-throughput system, HTS)으로 활용하기 위해 96-well 및 384-well plate 방식으로도 개발되어 제품이 판매되고 있다. 그 외에도 배양액을 유동시켜 세포가 표면에 부착하지 못하고 그들끼리 뭉치게 유도하거나 (Suspension culture) 자기부상 방식을 이용하기도 한다.
그 밖에도 생체모방 장기칩 (Organ-on-chip)의 기본 개념이 되는 미세유체 플랫폼 방식은 장치 내 구획된 공간에 세포를 배양하면서 배지의 미세한 흐름을 통해 지속적으로 영양공급과 산소유입, 노폐물 배출을 가능하게 한다. 세포가 존재하는 미세 환경을 모사하였기 때문에 각 장기에서 발생하는 약물의 흡수, 대사, 배출작용 및 면역작용 등 다양한 반응을 분석할 수 있다. 반도체 공정기술을 이용하여 채널의 모양을 자유롭게 만들 수 있으며, 투명하고 탄성이 강한 고분자 폴리메틸실록산 (Polydimethylsiloxane, PDMS), 폴리메틸메타크릴레이트
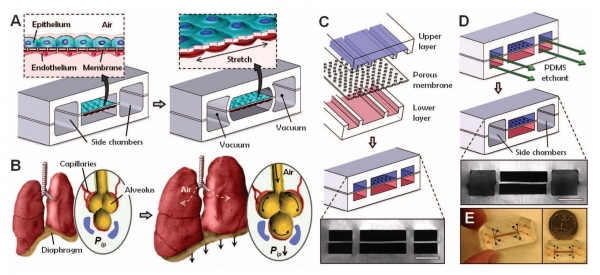
(polymethylmethacrylate, PMMA), 폴리카보네이트 (polycarbonate, PC), 폴리스타이렌 (polystyrene, PS) 등을 사용하여 세포 관찰도 용이하다. 이러한 소재의 특성은 장기의 정교한 모양과 역학을 모사할 수 있도록 하기 때문에 미세유체공학과 조직공학의 융합기술이라고 할 수 있다. 2010년 하버드대 뷔스 연구소 (Wyss institute, Harvard)에서 폐포의 움직임과 기체와의 맞닿은 특징을 그대로 반영하는 폐 칩 (Lung-on-a-chip)을 개발한 이래로 (그림 3, [7]) 지속적인 기술의 발전을 통해 현재는 피부, 눈, 심장, 동맥,콩팥 칩도 개발되어 있다. 이 기술은 약물 개발뿐만 아니라 동물실험이 금지되어 있는 화장품의 독성 및 효능평가에도 유용하게 사용될 수 있다.
3. 의약학 연구를 위한 3D 세포배양 기술
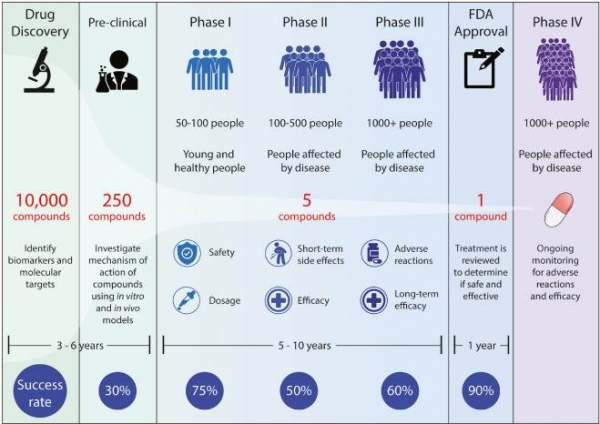
의약품 개발을 위해서는 효력물질의 탐색, 후보물질의 선별, 비임상 및 임상시험까지 일련의 과정이 진행된다. 최종적으로 한 가지의 신약을 개발하기 위해서는 초기연구단계에서 평균적으로 1만여 개에 달하는화합물이 평가되어야 하며, 신약개발까지 약 15 년이라는 긴 시간과 어마어마한 비용이 소요되고 그마저도실패로 돌아가는 일이 비일비재하다(그림 4). 최근에는 의약학 연구 및 제약산업의 규모가 커지면서 후보물질의 동물실험이 증가되어 소요비용이 늘어났을 뿐만 아니라 윤리적인문제도 함께 발생하고 있다.
그렇기 때문에 의약품 개발에서의실패율과 비용을 낮추기 위해서는 동물을 이용한 비임상 시험에서의 결과를 예측하는 능력을 향상시키는 것이 중요하다. 전통적으로 사용되어오고 있는 단층의 2D의 세포배양은 약물반응에 대한 매우 제한적인 정보, 심지어는 잘못된 정보를 제공할 수 있다. 3D 세포배양 시스템은 세포를 기본으로 하면서도 다층으로 구성되어 있어 in vivo와 유사한 세포신호기전을 가지므로 약물반응을 보다 실제적으로 나타낼 수 있기 때문에 약물 표적을 식별하고, 독성을 선별하고, 임상약물 효능과 인체에 대한 활성물질의 영향을 예측할 수 있는 모델 시스템으로 적합하다.
10여 년 전부터 많은 연구들을 통해 2D와 3D 세포배양 시스템에서의 약물반응을 비교 검증한 결과가 발표되었는데공통적인 결론은 다양한 약물에 대한 3D 세포의 반응은 2D와는 확연히 다르며 2D에서 배양한 세포들에 비해 약물반응이 덜 민감하다고 하였다 [8-10].
항암제 연구에서는 3D Spheroid가 유용하게 사용될 수 있다. 액체기반 시스템이므로 배지 교환이나 다 수의 화합물처리를 High throughput으로 적용하기에 scaffold-based 시스템보다 비교적 유연하게 할 수 있는 것이 장점이다. 단일 세포가 무한히 증식하여 자라는 암 덩어리를 그대로 모방한 구조이므로 산소와 영양분의 이질적 공급 또한 유사하게 모사가 가능하여 세포의 위치에 따른 약물 비효율성을 반영한 결과를 획득할 수 있다. 따라서 spheroid 형성 기술은 in vitro 항암제 효능평가에서 더욱 신뢰할 수 있는 결과를 얻게 한다. 환자 본인의 암세포를 이용해서 spheroid를 만들고항암제 반응성을 평가 한다면 개인화된 약물 선택 전략을 수립할 수 있을 것이다.
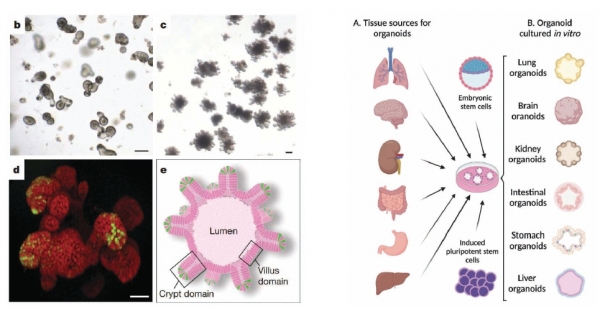
최근 의약학계에서는 하이드로겔로 구성한 오가노이드 배양모델을 활용한 연구가 주목을 받고 있다. 오가노이드는장기를 뜻하는 ‘Organ’과 유사함을 뜻하는 접미사 ‘-oid’가 합쳐진 단어로 체외에서 인위적으로 만든 유사 장기를 의미한다. 모방 장기의 세포를 하나 이상 가지고 있으며 장기의 모양을 유사하게 형성할 정도로 특화된 기능을 발현하는 등 생체대응성이 뛰어나기 때문에 세포 간의 상호작용 메커니즘 규명이나 질병의 기초연구 및 약물 개발에 활용될 수 있다. 2009년 네덜란드의 Hans Clever 교수 연구팀이 최초로 장 오가노이드를 만들며 그 개념을 소개하였고 (그림 5,[11,12]) 현재까지도 그를 포함한 제자들이 다양한 조직에 대한 오가노이드 개발을 활발히 해오고 있다.
하지만 이러한 수많은 장점과 필요성에도 불구하고 분명한 한계점은 존재한다. 제약산업에 활용되기 어려운 가장 큰 단점은 재현성 확보의 어려움이다. 세포는 ECM의 형태와 성질에 따라 반응에 차이를 나타낼 수 있기 때문에 3D 세포배양체 제작 시 매우 정교한 작업을 필요로 한다. 제약산업에서는 다수의 화합물의 약리활성 평가를 위해 HTS와의 접목이 필요하지만 각 개체가 매번 완벽히 일치하지 않기 때문에 재현성에 문제가 발생한다. 또한, 의약품 평가를 위해서는 assay validation이 필요한데 3D 세포배양 모델은 높은 수준의 생물학적 복잡성을 가지고 있기 때문에 다양한 질병 모델에서의 in vivo 결과를 획득하고 비교 검증을 해야 한다. 하지만 아직까지도 전 세계의 한정적인 그룹만이 관련 연구를 하고 있기 때문에 광범위한 in vitro 지표 데이터 확보에 한계가 있다. 기본적인 세포 관찰을 위해서도 일반 현미경이 아닌 공초점 현미경과 같은 고가의 장비가 필요하며 3D에서의 결과를 정량화 하기 위한 표준 분석방법도 부족하다.
이를 위해서는 endpoint에서의 바이오마커 분석보다는 실시간으로 감지하고 관찰할 수 있는 Probe의 개발로 결과를 정량화 할 수 있는 표준 분석방법이 개발 되어야 할 것이다.
4. 맺음말
3D 세포배양 시스템의 개발로 in vitro 실험은 많은 방면에서 동물의 조직과 유사해 졌다고 할 수 있다. 2D 배양에서는 구현할 수 없었던 세포의 복잡한 상호작용을 이해하고 활용할 수 있게 되었고 이를 통하여 세포 생리학적 현상에 대해 근본적 메커니즘을 탐구하는 기초과학부터 인공장기 이식을 목표로 하는 조직 공학까지 무수하게 응용이 되어 생명공학 산업의 발전을 도모하고 있다.
의약학 기술의 발전과 함께 3D 세포배양 시스템은 환자 맞춤형 의약품 및 치료 방법의 개발이나 장기이식을 위한 가능성을 모니터링 할 수 있는 잠재력을 가질 수 있게 한다. 또한 2D에서는 예측이 어려운 면역학적 복잡성에 대한 정보와 약물효력 시험 결과에 대한 신뢰도를 높인다. 이는 비임상 및 임상시험으로 진입하는 데에 있어 실패 확률을 낮출 것이며 결국 암을 포함한 다양한 불치병에 더욱 효과적인 치료법 개발을 도울 것이다. 하지만 20여 년 전부터 그 중요성이 강조되어 왔음에도 불구하고 아직도 대부분의 제약산업에서는 2D 세포배양 표면을 기본으로 약물의 효력평가를 진행하고 있다.
분명 3D 세포배양 기술에는 제약이 있지만 그럼에도 불구하고 플라스틱 접시에 대한 아쉬움으로 전환의 필요성에 대한 주장은 지속되고 있다. 더 많은 연구자들이 적극적인 전환을 위한 자세를 가져야 하며 이는 한계점에 대해 빠른 해결책을 찾을 수 있게 도울 것이다. 이를 위해서는 정부의 중장기적 기초과학의 지원도 반드시 필요하다. 머지않은 미래에 3D 세포배양 방법이 기초과학분야 및 제약산업에 일상적으로 활용되어 보다 효율적으로 시간과 비용을 절감하여빠른 신약개발 및 생명과학의 비약적인 발전이 있기를 기대해 본다.
참고문헌
1. Charwat, V., & Egger, D. (2018). The third dimension in cell culture: From 2D to 3D culture formats. In Cell Culture Technology (pp.75-90). Springer, Cham.
2. Habanjar, O., Diab-Assaf, M., Caldefie-Chezet, F., & Delort, L. (2021). 3D cell culture systems: tumor application, advantages, and disadvantages. International journal of molecular sciences, 22(22), 12200.
3. Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., & Solomon, F. P. (2015). 3D cell culture systems: advantages and applications. Journal of cellular physiology, 230(1), 16-26.
4. D4uval, K., Grover, H., Han, L. H., Mou, Y., Pegoraro, A. F., Fredberg, J., & Chen, Z. (20517). Modeling physiological events in 2D vs. 3D cell culture. Physiology, 32(4), 266-6277.
5. Jense7n, C., & Teng, Y. (2020). Is it time to start transitioning from 2D to 3D cell culture?. Frontiers in molecular biosciences, 7, 33.
6. Zhang, C., Yang, Z., Dong, D. L., Jang, T. S., Knowles, J. C., Kim, H. W., ... & Xuan, Y. (2020). 3D culture technologies of cancer stem cells: promising ex vivo tumor models. Journal of tissue engineering, 11, 2041731420933407.
7. Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y., & Ingber, D. E. (2010). Reconstituting organ-level lung functions on a chip. Science, 328(5986), 1662-1668.
8. Belfiore, L., Aghaei, B., Law, A. M., Dobrowolski, J. C., Raftery, L. J., Tjandra, A. D., ... & Engel, M. (2021). Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences, 163, 105876.
9. Park, Y., Huh, K. M., & Kang, S. W. (2021). Applications of biomaterials in 3D cell culture and contributions of 3D cell culture to drug development and basic biomedical research. International Journal of Molecular Sciences, 22(5), 2491.
10. Langhans, S. A. (2018). Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in pharmacology, 9, 6.
11. Sato, T., Vries, R. G., Snippert, H. J., Van De Wetering, M., Barker, N., Stange, D. E., ... & Clevers, H. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459(7244), 262-265.
12. Ramírez-Flores, C. J., & Knoll, L. J. (2021). Breakthroughs in microbiology made possible with organoids. PLoS Pathogens, 17(11), e1010080.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update