| 간(liver) 기능 모사를 위한 조직칩의 개발 | |
|---|---|
| Date 2022-04-09 18:23:11 |
|

교수 / 석사과정
한양대학교 바이오나노학과
vincero78@hanyang.ac.kr / ajk0611@naver.com
1. 서론
간은 아미노산, 탄수화물, 질소의 해독 작용 및 활성화에 중요한 역할을 한다 [1,2]. 이러한 역할에 따라 알부민, 요소 및 담즙은 혈액과 장으로 분비되고 포도당은 간에서 저장되며 생성된다 [2]. 또한 독소, 약물 및 화학물질은 대사를 통해 간에서 변형되는데 약물의 효능에 영향을 미치고 간 독성 및 간 손상을 유발할 수 있다. 이는 약물 개발을 위해 간에서 일어나는 과정을 정확히 예측하는 것이 중요함을 나타낸다 [3,4]. 약효의 정확한 예측은 간 모델이 생리학적 연관성을 가질 때 이루어지는데 기존의 세포기반 시험관내 모델은 생리학적 연관성 부족으로 약물 효능을 예측하는 데 한계가 있다 [5-7]. 최근, 마이크로 기술 발전으로 인해 마이크로칩이 개발되었고 생리학적 관련성이 증가한 생체 내 환경을 모방하기 위해 활용되었다. 이러한 노력으로 다양한 간조직칩 모델, 즉 Liver-on-a-chip 모델이 개발되었다. 더 나아가, Liver-on-a-chip 모델은 다른 장기 모델과 연결되어 사용되어 다중 장기 칩 모델이 되었고 이들은 다른 장기들 사이의 복잡한 상호작용을 연구할 수 있었다 [8,9]. 본 기고문에서는 간의 환경을 모방하는 Liver-on-a-chip 모델과 장-간의 상호작용을 연구하기 위한 장-간 모델의 최근 연구 동향을 요약한다. 또한 Liver-on-a-chip 모델에 대한 향후 방향과 더 나은 시험관내 모델 시스템을 개발하기 위한 과제를 제안하고자 한다.
2. 간의 생리학
2.1. 간의 구조 및 기능
조직학적으로 간은 육각형의 구조로 배열된 여러 개의 소엽 (lobule)으로 구성되어 있으며, 각 소엽에는 중심 정맥 (central vein)과 모서리에 있는 간삼각 (hepatic portal triad)이 존재한다. 간삼각은 간문맥 (hepatic portal veins), 간동맥 (hepatic artery), 담즙관 (hepatic bile duct)으로 구성되며 [10,11], 간문맥과 간동맥에서 공급된 영양분과 산소가 풍부한 혈액이 간 동양혈관 (sinusoid)을 통해 중심 정맥으로 흘러간다.
간 동양혈관은 간의 기본 구조 단위이며 실질 (parenchymal) 세포와 비실질 (non-parenchymal) 세포로 구성된다 [12]. 실질 세포는 동양혈관을 따라 존재하는 간세포 (hepatocyte)이다. 비실질세포는 성상세포 (stellate cells), 간 동양혈관 내피세포 (liver sinusoidal endothelial cells), 쿠퍼세포 (Kupffer cell)로 구성된다 [2]. 간 동양혈관 내피세포는 동양혈관을 형성하고 있는 내피세포로서 혈액과 직접 접촉한다 [13]. 간 성상 세포는 간세포와 동양혈관 사이에 위치한 Disse 공간에 있는 섬유아세포이다 [14]. 성상 세포는 간 동양혈관 내피세포의 형태를 유지하고 감염 및 알코올 섭취 후 변화하는 환경에 반응하여 활성화될 때 세포 외 기질 (ECM)의 침착을 활성화한다. 쿠퍼 세포는 간 동양혈관의 간 동양혈관 내피세포에 고정된 간의 대식세포로 외부 물질을 제거하고 다양한 사이토카인을 방출한다 [15].
간은 탄수화물, 지질, 아미노산 대사, 암모니아 제거, 요소 합성, 알부민 및 담즙산 합성과 같은 다양한 기능을 수행한다 [16]. 신진대사는 1상과 2상으로 분류된다 [3]. 1상 대사는 사이토크롬 P450 (CYP 450)에 의해 수행되며, 약물은 산화, 환원, 가수분해, 탈수소화에 의해 변형된다. 2상 대사에는 황산화 또는 글루크론산화가 포함되며, 전이효소에 의해 수행된다 [17]. 2상 대사 후, 변형된 약물은 신장을 통해 배설될 수 있다.
2.2. 간 모델 구축을 위한 세포 공급원
생체 내 모델과 유사한 시험관내 간 모델을 구성하기 위해서는 간세포의 공급원이 중요하다. 간세포 공급원에는 1차 간세포, 간세포주, 줄기세포 유래 간세포가 포함된다. 1차 간세포는 마우스, 랫트, 인간과 같은 다양한 종의 간에서 분리될 수 있다. 이 세포들은 1상 및 2상 효소 활동을 포함하여 간 기능을 수행한다. 그러나 1차 간세포는 증식하지 않고 빠르게 간 기능을 상실하기 때문에 계대 배양이 어렵다. 간세포주는 암세포로부터 유래된다. 사람의 간세포 암종에서 얻은 HepG2 세포는 dish나 plate에서 안정적으로 배양할 수 있다. 그러나 간 기능을 재현하는 데에는 한계가 있다. HepaRG 세포는 간염 바이러스에 감염된 환자의 간세포 암종에서 유래한 간 전구 세포이다 [18]. HepaRG 세포는 분화를 통해 1차 간세포와 유사한 특성을 나타낼 수 있다. 또한 HepG2 세포와 비교하여 간 기능을 더 잘 재현할 수 있지만, 1차 간세포에 비해 간독성 약물의 검출 민감도는 낮다 [19].
Liver-on-a-chip 모델을 구축하기 위한 주요 장애물 중 하나는 세포원의 제한된 공급이다. 연구자들은 이러한 한계를 해결하기 위해 만능줄기세포 (PSC)의 사용을 제안했다. 이 세포들은 안정적인 간 기능과 배치 간의 낮은 가변성을 보여 주지만 배양에는 오랜 시간(15일 이상)이 걸릴 수 있으며 분화를 중재하기 위해서는 유도 요인이 필요하다 [20]. 또한, 이들 세포의 대사 활성은 1차 간세포와 HepaRG 세포보다 낮아서 1차 간세포를 대체하기 위해서는 분화 프로토콜의 개발이 필요하다 [21].
3. 간 조직칩 모델
3.1. 구조적 특징을 재현한 모델
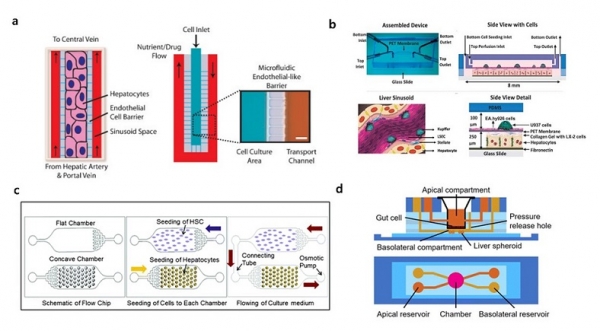
연구자들은 간 동양혈관을 모방하기 위해 미세 유체 장치에 내피 장벽을 통합했다. 간 동양혈관에서 간세포는 수많은 모세혈관을 통해 영양분과 산소를 공급받는다. 그러나 기존의 배양 시스템은 이러한 공급 환경을 재현하는 데 실패했다. 이러한 한계를 극복하기 위해 여러 연구가 수행되었고, 마이크로 기술을 사용하여 내피 장벽을 재현하는 pillar가 개발되었다. Pillar 내부에서 간세포를 배양하고, 외부를 통해 세포 배양액을 공급해 pillar 사이의 틈으로 간세포에 산소와 영양분을 공급할 수 있었다. 캘리포니아 버클리대학의 Luke Lee 교수 연구팀은 세포 배양 영역을 둘러싸는 내피 유사 장벽을 설계했다 (그림1a) [22]. 1차 간세포를 세포 배양 영역에 옮긴 후, 세포 배양 배지는 혈관에서 내피-유사 장벽으로 확산되도록 하였다. 이러한 조건에서 랫드와 인간의 1차 간세포 생존력은 7일 이상 유지되었다. 저자는 대사 유도 간세포 독성의 발생을 조사하기 위해 세포에 diclofenac을 처리했다. 간세포가 diclofenac에 4시간 동안 노출되어도 생존력이 유지되었으나 24시간 동안 노출되면 약물의 독성으로 세포가 사멸되었다. 이는 내피 유사 장벽을 통합하고 동양혈관 구조에서 혈류를 재현하는 선구적인 연구이다. 이처럼 간 조직의 구조를 모방한 시스템을 통해 간 세포의 기능을 향상시킬 수 있었는데 동양혈관 및 소엽 구조와 같은 간세포를 둘러싼 구조적 특징의 재현이 세포로부터 실제 반응을 이끌어내는 데 중요한 의미를 갖는다는 것을 보여준다.
그림 1. 간 조직칩 모델 (a) 구조적 특징을 재현한 모델 [22] (b) 비실질 세포를 이용한 공동 배양 모델 [26] (c) 3차원(3D) 클러스터 기반 모델 [31] (d) 장-간 상호작용 시뮬레이션을 위한 다중 장기 모델 [34].
3.2. 비실질 세포를 이용한 공동 배양 모델
간은 실질 세포와 비실질 세포로 구성된다. 실질 세포는 간 질량의 80%를 구성하고 간세포로 구성되며, 비실질 세포는 간 질량의 20%를 구성하고 간 동양혈관 내피 세포, 간 성상 세포 및 쿠퍼 세포 (Kupffer cell)로 구성된다 [23]. 비실질 세포는 간의 적은 부분을 차지하지만, 간세포 사이의 커뮤니케이션을 확립하고 세포 기능을 제어하는 데 중요하다 [24,25]. 여러 연구들은 미세유체 시스템에서 비실질 세포와 간세포의 공동 배양에 중점을 두었다.
하버드대학교의 Prodanov 등은 미세유체 채널을 포함하는 두 개의 PDMS 층을 설계했다 (그림1b) [26]. Polyethylene terephthalate 막을 사용하여 미세유체 채널을 상하채널로 분리하였다. 1차 간세포 및 LX-2 세포(인간 간 성상 세포주)는 하단 채널에 배양했다. EAhy926 세포(인간 제대 정맥 세포주; EAhy926 세포는 동양혈관 내피 세포를 나타냄) 및 U937 세포(전단핵구, 인간 조직구 림프종 세포주; U937 세포는 쿠퍼 세포를 나타냄)를 상단 채널에 배양했다. 세포 배양 배지는 상부 채널에 공급했다. 공동배양을 통해 세포 생존은 28일 동안 유지되었고, 간세포의 분극화와 미세담관의 네트워크 형성이 관찰되었다. 유동 조건에서 알부민과 요소 합성은 정적 조건에서 관찰된 것보다 더 높았다. 이 연구를 통해 비실질 세포주(LX-2, U937 및 EAhy926)를 간세포와 공동 배양하여 유동 조건에서 장기간 배양할 수 있을 입증하였다. 다양한 연구들이 미세유체 시스템의 설계와 세포의 유형은 다르지만, 유동 조건에서 간세포와 비실질 세포의 공동 배양은 생체 내 간 기능과 더 정확하게 유사하도록 간기능을 향상시켰다. 이러한 연구를 바탕으로 유동 조건에서 공동 배양은 생리학적으로 관련된 liver-on-a-chip 시스템 구축에 필수적인 요소로 고려해야 한다.
3.3. 3차원(3D) 클러스터 기반 모델
몇몇 연구자들은 생체 내 3차원 세포-세포 및 세포-세포 외 기질 (ECM) 상호 작용에 중점을 두었다 [27]. 간 세포의 2차원 배양 모델이 일반적으로 약리학적 목적을 위해 사용되었지만, 3차원 상호 작용을 시뮬레이션하는 데에는 한계가 있었다. 이러한 한계를 극복하기 위해 간세포 또는 iPSC를 사용하여 스페로이드 및 오가노이드를 기반으로 하는 3D 클러스터 모델이 개발되었다 [28]. 3D 클러스터 모델은 생체 내 환경의 3차원 상호 작용이 보다 정확하게 재현되었기 때문에 2D 모델의 간 특이적 기능을 개선했다 [29].
또한 여러 연구는 3D 클러스터 구조에서 실질 세포와 비실질 세포 사이의 상호 작용에 중점을 두었다. 고려대학교 이상훈 교수팀은 PDMS를 사용하여 오목한 microwell array를 제작했다 [30,31]. 오목한 microwell array는 평면 및 원통형 microwell에 비해 균일한 크기의 spheroid 형성을 촉진했다. 저자는 1차 간세포와 간 성상 세포 유래 heterosphere에 의한 알부민 분비가 1차 간세포 유래 hepatosphere보다 1.2배 더 높다는 것을 입증했다. 다음 연구에서는 오목한 well과 삼투압 펌프 기반 미세유체 시스템을 결합했다 (그림 1c). 유체의 흐름은 직접적인 세포 대 세포 접촉이 없어도 스페로이드를 형성해 장기간 유지되도록 하며, 1차 간세포와 간 성상 세포 유래 스페로이드 사이의 세포 간 커뮤니케이션이 확립되도록 하였다. 단일 배양된 간세포의 스페로이드와 비교했을 때 흐름과 접촉한 1차 간세포 및 간 성상 세포는 알부민 분비가 2배 증가하고 요소 합성이 1.5배 증가하는 것으로 나타났다. 이 연구에서는 실질 세포와 비실질 세포 간의 커뮤니케이션을 위해 미세유체 시스템이 이용되고, 세포 간 커뮤니케이션이 중요함을 밝혀냈다. 이처럼 3차원 클러스터를 형성하기 위해 다양한 방법이 도입되었으며 이러한 클러스터는 간 기능을 향상시켰다.
3.4. 장-간 상호작용 시뮬레이션을 위한 다중 장기 모델
투여된 식품 및 약물은 소장을 통과한 후 정맥을 통해 간으로 전달되고 1상 및 2상 대사에 의해 대사된다. 이러한 과정을 초회 통과 대사 (first-pass metabolism)라 하며 약물의 효과를 결정하고 약물의 작용 기전을 이해하는 데 중요하다. 여러 연구에서 장 구획과 간 구획은 초회 통과 대사를 시뮬레이션하기 위해 마이크로 채널로 연결되었다 [32]. 식품과 약물의 성분은 장 구획에서 대사되어 마이크로 채널을 통해 간으로 전달된 다음 장 대사 산물은 간에서 대사된다. 따라서 이러한 장과 간 상호 작용은 음식과 약물이 다른 장기에 미치는 영향을 시뮬레이션할 수 있다.
여러 연구에서 생체 내 시스템을 더 정확하게 시뮬레이션하기 위해 유체 대 조직의 비율에 중점을 두었다. 홍익대학교의 성종환 교수팀은 장 (Caco-2) 세포와 간 (HepG2) 세포에 대해 두 개의 별도 층으로 구성된 장-간 칩을 개발했다 [33]. 장 및 간 세포는 중력 유동 기계를 사용하여 단일 칩에서 배양되었다. 공동 배양은 CYP 효소의 대사 활성을 향상시켰고, flavonoid apigenin의 대사 프로필은 보고된 프로필과 유사했다. 후속 연구에서 Caco-2 세포는 장 구획의 3차원 융모 지지체에서 배양된 반면, 간 스페로이드는 간 구획에서 배양되었다 (그림 1d) [34]. 3차원 배양은 흡수 표면적이 더 크고 대사 능력이 좋기 때문에 2차원 모델에 비해 더 정확한 약물의 효능을 예측하였다. 장과 간 사이의 상호 작용을 연구하기 위해 여러 연구가 수행되어 왔고, 지금도 많은 연구자들이 이러한 상호 작용을 생체 내 조건에 더 가깝게 시뮬레이션하기 위해 노력하고 있다.
4. 남은 과제 및 결론
Liver‐on‐a‐chip 시스템은 상당한 잠재력을 보여주지만, 더 개선된 시험관내 모델을 개발하기 위해서는 극복해야 할 몇 가지 과제가 있다. 첫째, 간의 기능을 더 정확하게 재현하기 위해서는 생리학적 연관성이 개선된 인간 유래 세포를 liver-on-a-chip 시스템에 적용해야 한다. 여러 연구에서는 저렴하고 안정적이며 세포 기능을 쉽게 제어할 수 있어 HepG2 세포와 같은 불멸화된 세포주를 사용했다. 그러나 이러한 세포는 암에서 유래하며 기능이 제한적이다. 이러한 한계를 극복하기 위해 최근 연구에서 1차 간세포가 liver-on-a-chip의 구축에 사용되었다. 1차 간세포는 더 나은 기능을 나타내지만, 인간으로부터 세포를 추출하고 기능을 유지하기 어렵기 때문에 1차 세포의 활용이 어렵다. 다른 방안으로 liver-on-a-chip 시스템 개발에 hiPSC를 사용한다. hiPSC는 간세포로 분화시키는 것이 어렵지만, 인간과 생리학적으로 연관된 개인 맞춤형 생물학적 정보를 제공할 수 있다는 장점이 있다. 둘째, 간은 종종 다른 기관과의 상호 작용을 통해 다양한 기능을 수행하기 때문에 liver-on-a-chip 시스템에서 전체 기능을 유지하는 것이 중요하다. 따라서 간 기능 분석을 위해 칩에서 분비된 대사산물과 대사된 약물을 지속적으로 채취해야 한다. 그러나 반복적인 시료 채취는 칩 작동을 방해하여 시료의 농도에 영향을 미친다. 따라서 실시간 모니터링 시스템이 칩에 통합되어야 한다. 유사한 관점에서, 소형화된 현미경과 칩의 조합은 세포 형태에 대한 실시간 정보를 제공할 수 있다. 면역조직화학, 투과성, 상피전기저항 (TEER), 이동 분석, 혈관 신생 및 기타 분석 등은 칩에서 측정할 수 있는 지표의 예이다 [35].
이 기고문에서 우리는 약물 대사 연구를 위한 다양한 liver-on-a-chip 시스템을 소개했다. 마이크로 기술은 기존의 체외 시스템의 개선을 가능하게 하고, 보다 생리학적으로 연관된 간 모델을 개발할 수 있게 하였다. 또한 간 시스템은 미세유체 공학을 통해 장 모델과 연결되어 약물의 흡수 및 대사를 재현하는 데 도움이 되었다. 이 기고문에서 논의된 연구들은 liver-on-a-chip 시스템의 잠재력을 보여주었으며 앞으로의 나아가야 할 방향을 보여준다.
참고문헌
1. Kang, Y.B.A., et al., Metabolic patterning on a chip: towards in vitro liver zonation of primary rat and human hepatocytes. Scientific reports, 2018. 8(1): p. 1-13.
2. Deng, J., et al., Engineered liver-on-a-chip platform to mimic liver functions and its biomedical applications: A review. Micromachines, 2019. 10(10): p. 676.
3. Lee, S.H., et al., Microtechnology-based organ systems and whole-body models for drug screening. Biotechnology journal, 2016. 11(6): p. 746-756.
4. Moradi, E., S. Jalili-Firoozinezhad, and M. Solati-Hashjin, Microfluidic organ-on-a-chip models of human liver tissue. Acta biomaterialia, 2020. 116: p. 67-83.
5. Jodat, Y.A., et al., Human-derived organ-on-a-chip for personalized drug development. Current pharmaceutical design, 2018. 24(45): p. 5471-5486.
6. Lee, S.H., N. Choi, and J.H. Sung, Pharmacokinetic and pharmacodynamic insights from microfluidic intestine-on-a-chip models. Expert opinion on drug metabolism & toxicology, 2019. 15(12): p. 1005-1019.
7. Sung, J., Y. Wang, and M. Shuler, APL Bioeng. 3, 021501 (2019).
8. Boeri, L., et al., Advanced organ-on-a-chip devices to investigate liver multi-organ communication: focus on gut, microbiota and brain. Bioengineering, 2019. 6(4): p. 91.
9. Sung, J.H., et al., Recent advances in body-on-a-chip systems. Analytical chemistry, 2018. 91(1): p. 330-351.
10. Snyder, C.J., Injuries to the portal triad. American Journal of Surgery, 1993. 166(3): p. 318-318.
11. Lorente, S., M. Hautefeuille, and A. Sanchez-Cedillo, The liver, a functionalized vascular structure. Scientific Reports, 2020. 10(1): p. 1-10.
12. Jungermann, K. and T. Keitzmann, Zonation of parenchymal and nonparenchymal metabolism in liver. Annual review of nutrition, 1996. 16(1): p. 179-203.
13. Poisson, J., et al., Liver sinusoidal endothelial cells: Physiology and role in liver diseases. Journal of hepatology, 2017. 66(1): p. 212-227.
14. Sawitza, I., et al., The niche of stellate cells within rat liver. Hepatology, 2009. 50(5): p. 1617-1624.
15. Chen, J., et al., Kupffer cells in non-alcoholic fatty liver disease: Friend or foe? International Journal of Biological Sciences, 2020. 16(13): p. 2367.
16. Taub, R., Liver regeneration: from myth to mechanism. Nature reviews Molecular cell biology, 2004. 5(10): p. 836-847.
17. Zamek-Gliszczynski, M.J., et al., Integration of hepatic drug transporters and phase II metabolizing enzymes: mechanisms of hepatic excretion of sulfate, glucuronide, and glutathione metabolites. European journal of pharmaceutical sciences, 2006. 27(5): p. 447-486.
18. Dubois-Pot-Schneider, H., et al., Inflammatory cytokines promote the retrodifferentiation of tumor-derived hepatocyte-like cells to progenitor cells. Hepatology, 2014. 60(6): p. 2077-2090.
19. Gerets, H., et al., Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell biology and toxicology, 2012. 28(2): p. 69-87.
20. Ehrlich, A., et al., Challenges and opportunities in the design of liver-on-chip microdevices. Annual review of biomedical engineering, 2019. 21: p. 219-239.
21. Kvist, A.J., et al., Critical differences in drug metabolic properties of human hepatic cellular models, including primary human hepatocytes, stem cell derived hepatocytes, and hepatoma cell lines. Biochemical Pharmacology, 2018. 155: p. 124-140.
22. Lee, P.J., P.J. Hung, and L.P. Lee, An artificial liver sinusoid with a microfluidic endothelial-like barrier for primary hepatocyte culture. Biotechnology and bioengineering, 2007. 97(5): p. 1340-1346.
23. Werner, M., et al., All-in-one: advanced preparation of human parenchymal and non-parenchymal liver cells. PloS one, 2015. 10(9): p. e0138655.
24. Marrone, G., V.H. Shah, and J. Gracia-Sancho, Sinusoidal communication in liver fibrosis and regeneration. Journal of hepatology, 2016. 65(3): p. 608-617.
25. Peters, K.M., R.B. Wilson, and N.M. Borradaile, Non-parenchymal hepatic cell lipotoxicity and the coordinated progression of nonalcoholic fatty liver disease and atherosclerosis. Current opinion in lipidology, 2018. 29(5): p. 417.
26. Prodanov, L., et al., Long-term maintenance of a microfluidic 3D human liver sinusoid. Biotechnology and bioengineering, 2016. 113(1): p. 241-246.
27. Edmondson, R., et al., Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and drug development technologies, 2014. 12(4): p. 207-218.
28. Liu, H., et al., Advances in hydrogels in organoids and organs-on-a-chip. Advanced materials, 2019. 31(50): p. 1902042.
29. Fang, Y. and R.M. Eglen, Three-dimensional cell cultures in drug discovery and development. Slas discovery: Advancing Life Sciences R&D, 2017. 22(5): p. 456-472.
30. Wong, S.F., et al., Concave microwell based size-controllable hepatosphere as a three-dimensional liver tissue model. Biomaterials, 2011. 32(32): p. 8087-8096.
31. Lee, S.-A., et al., Spheroid-based three-dimensional liver-on-a-chip to investigate hepatocyte–hepatic stellate cell interactions and flow effects. Lab on a Chip, 2013. 13(18): p. 3529-3537.
32. Lee, S.H. and J.H. Sung, Microtechnology-based multi-organ models. Bioengineering, 2017. 4(2): p. 46.
33. Choe, A., et al., Microfluidic Gut-liver chip for reproducing the first pass metabolism. Biomedical microdevices, 2017. 19(1): p. 1-11.
34. Lee, D.W., et al., 3D gut-liver chip with a PK model for prediction of first-pass metabolism. Biomedical microdevices, 2017. 19(4): p. 1-13.
35. Junaid, A., et al., An end-user perspective on Organ-on-a-Chip: Assays and usability aspects. Current Opinion in Biomedical Engineering, 2017. 1: p. 15-22.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update