| 미세액적 (microdroplet) 기반 효소활성 스크리닝 | |
|---|---|
| Date 2022-04-09 18:03:00 |
|

교수 / 석사과정
한밭대학교 화학생명공학과
sanghunlee@hanbat.ac.kr / minzero0910@gmail.com
머리말
미세유체 시스템 (microfluidics)은 최근 수년간 기술의 효율성과 응용에 대한 잠재력으로, 많은 연구자들에게 관심을 받고 있다. 미세유체 시스템은 “랩온어칩 (Lab-ona-chip)” 즉, 작은 크기의 칩 (chip) 상에서 구동이 가능하며, 소량의 시약사용, 반응시간의 절약, 간편화/자동화된 실험 방법, 상업화를 위한 scale-up 비용절감 등 많은 이점을 가지고 있다. 또한 최근에는 분자/면역진단을 포함하는 현장진단 (point-of-care testing, POCT) 시스템, 유기합성, 약물활성테스트, 신약개발, 파티클 합성 등 다양한 분야에서 연구가 진행중이다 [1,2]. 미세유체 시스템에서의 유체는 매우 낮은 레이놀즈수 (Reynolds number)를 가지므로 층류 (lamina flow)를 형성하며 유체유동이 이루어진다. 이러한 유체 유동 특성을 파악하여 유체의 온도, 점도, 전단 응력 등 물리적 조건을 제어하므로 다양한 실험의 진행 또한 가능하다 [3,4]. 미세액적 (microdroplet) 기반 미세유체 시스템은 물리, 화학, 생물학 등의 분야에서 신속하고 저비용으로 고처리량 스크리닝 (high-throughput screening) 활용도가 높은 시스템으로서 다양한 연구가 진행되고 있다. 주로 피코리터 (picoliter) 볼륨의 작은 부피를 갖는 미세액적은 신약개발 및 화학합성 등에 활용 가능하며, 기존의 스크리닝 방법들과 비교할 때 단일세포, 효소활성 등의 스크리닝, 분리 플랫폼으로 적합하게 활용가능한 기술임을 알 수 있다 [5-7]. 본 기고문에서는 미세유체 시스템을 이용한 미세액적기반 효소활성 스크리닝 시스템에 대해 소개하고자 한다.
1. 미세액적 기반의 미세유체 시스템
최근 미세유체 시스템의 발전으로 인해 매우 균일한 미세액적을 빠르고 효율적으로 제조할 수 있게 되었다. 미세유체 채널 내에서의 유체는 층류 (lamina flow)의 형태로 유동하는데, 상이한 물질들이 혼합할 경우 확산으로만 이루어지는 특성을 띤다 [2,3]. 미세액적은 친수성 (hydrophilic)과 소수성 (hydrophobic)의 서로 섞이지 않는 특징을 이용하며, 작게는 피코리터, 크게는 나노리터 (nanoliter) 부피의 물방울이다. 작은 부피에는 여러 이점들이 존재하는데, 생성된 미세액적의 크기는 마이크로 범위에서 높은 표면적 대 부피 비 (surface-to-volume ratio)로 인해, 물질전달/확산 및 열전달에 걸리는 시간과 필요한 거리가 감소하며 이러한 특성으로 인해 신속한 반응을 유도할 수 있다 [4,5]. 물리적인 관점에서 미세액적의 균일성은 실험 목적에 따라서 매우 중요한 요인이 될 수 있으며, 전단력 (shear force)과 전단응력 (shear stress) 등 여러가지 제반사항들을 제어하여 제조된다. 균일한 미세액적 생성을 위해 마이크로 크기의 채널로 구성된 미세유체 장치를 사용할 수 있으며, 표면장력과 점성력과의 균형을 제어하여 단분산성 (mono-dispersion) 미세액적 생성이 가능하다 [6]. 초기의 미세유체 시스템 (microfluidic microdroplet generator)은 MEMS (micro-electro-mechanical system) 기술을 이용하여 제작되었으며,실리콘 및 유리 등으로 구성되어 높은 수준의 기계적 강도를 갖지만 실험 시 멸균 등 관리가 필요하고 제작과정이 복잡하여 많은 시간/비용이 소비되는 단점이 존재한다. 최근에는, 실리콘, 유리와 같은 무기재료가 아닌 PDMS (polydimethylsiloxane), PMMA (polymethylmethacylate) 등 유기재료의 사용과 포토리소그래피 (photo-lithograghy)와 소프트리소그래피 (soft-lithography) 기술을 이용해 간단한 공정으로 대량생산이 가능하다. 따라서 저비용의 고분자 재료와 작은 부피의 채널을 활용하므로 경제적인 이점을 갖고, 생물학 실험에서는 미세유체 장치를 일회성으로 사용하므로 멸균과정이 불필요한 이점을 가지게 되었다.
2. 미세유체 시스템을 이용한 액적 형성
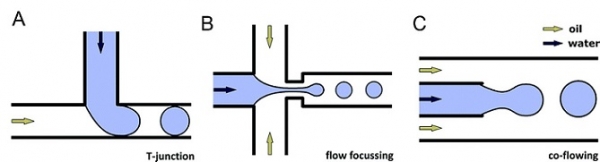
그림 1. 미세액적기반 유체시스템 예시 (A) T-shaped junction, (B) flow-focusing ,(C) co-flowing [4].
PDMS, PMMA 등 고분자 재료 및 MEMS 기술로 제작된 미세액적 유체칩은 구조와 기능에 따라서 T-junction, flowfocusing, 마이크로 밸브, 디지털 미세액적 시스템으로 구분 가능하다 [7]. 구조상 미세액적은 유체가 서로 교차하는 지점에서 연속상의 전단력에 의해 분산상이 끊어지면서 생성된다. T-junction 은 T자 형상의 채널을 활용하며, 두 채널의 크기와 형태, 유체의 속도, 표면장력 등 물리적 변수들을 고려하여 미세액적의 크기와 균일성의 조절이 가능하다 (그림 1A). 미세초점 (Flow-focusing) 방법은 대칭적인 전단력에 의해 미세액적이 형성되므로 T-junction보다 효율적으로 미세액적의 형성이 가능하다. 분상상의 주입되는 유로 양측에 두개의 연속상이 채널을 통해 대칭으로 주입되는 형태로, 균일한 미세액적을 생성하게 된다 (그림 1B, C). 마이크로 밸브 기반 미세액적은 T-junction과 같은 구조의 채널 입구에 있는 밸브의 개폐에 따라 미세액적을 절단하며 생성시킨다. 그로 인해 정교하고 정확한 크기의 미세액적 생성이 가능하며, 밸브 개폐 속도를 조절하여 액적의 크기와 수를 실시간으로 제어가 가능하다. 또한 디지털 미세액적 기술은 채널 내에 유동하는 유체에 전기장을 이용하여 원하는 크기와 수로 미세액적을 생성할 수 있다. 컴퓨터 프로그램을 통해 유체의 속도, 혼합 등을 조절 가능하고 원하는 경로로 유체를 제어할 수 있는 이점을 갖지만, 칩 제작 공정이 복잡하고 전극이 포함된 칩을 사용하므로 별도의 칩제작을 고려해야 한다.
3. 미세액적 기반 효소활성 스크리닝 플랫폼
효소공학은 식품, 바이오, 화학 촉매 등 여러 분야에서 중요한 의미를 갖는다. 효소는 입체성 및 기질 특이성을 갖고 온도, pH에 대해 민감하게 반응하므로, 안정된 환경에서 스크리닝을 진행하는 것이 바람직하다 [7]. 기존의 효소활성 스크리닝을 위한 시스템에서는, 쉐이크 플라스크 (shake flask) 또는 마이크로 플레이트 (microtiter plate) 등의 방법들을 활용하였지만, 다량의 시약 및 시간 소비로 인해 효율적인 스크리닝 플랫폼의 필요가 제기되었다. 따라서, 최근 미세유체 시스템을 이용한 효소 활성 분석을 위한 분자생물학적 연구가 꾸준히 진행되고 있으며, 대용량 반응의 처리가 가능한 고처리량 플랫폼으로 효율적인 스크리닝이 가능해졌다 [8]. 이 같은 미세액적 기반 효소활성 스크리닝 플랫폼은 소량시약 소비, 신속한 반응 등 스크리닝 절차에 있어 보다 지속가능하고 유용한 강점을 갖는다. 다만, 미세액적 기반 스크리닝 방법은 연구개발 단계에 있으며, 상기의 잠재력을 최대한 활용하기 위해서 일부 고려해야 할 부분이 존재한다. 그 중 하나는 높은 온도에서 효소 스크리닝을 수행하는 것이다. 미세액적이 온도 상승에도 견딜 수 있다는 것이 여러 연구에서 밝혀졌지만, 효소 분석은 그 중 일부에 국한되어 있다. 그 이유로는 효소 활성 스크리닝에서 미세액적에 병합, 염료 누출 및 높은 백그라운드 형광신호 등이 있다. 이러한 문제를 해결하기 위해, 미세액적 트랩된 효소에 짧은 열충격만을 가하여 효소의 안정성을 높이는 방안 또한 고려되고 있다 [9,10].
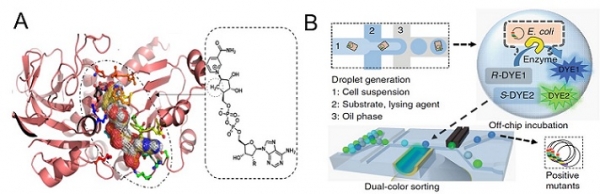
그림 2. 미세액적 기반 효소활성 스크리닝 모델, (A) 보조인자로 인해 안정화된 탈수소효소 모델 [10], (B) 미세유체 기반 esterase 스크리닝 개략도 [11].
예를 들어, 산화환원효소는 전자의 전달을 촉매하여 기질을 산화 또는 환원시키는 효소이다. 효율적인 촉매 작용을 위해 전자공여체와 수용체에 기질특이성을 가지며, 일반적으로 NADH, NADPH, 수소 등의 전자공여체, NAD, NADP 등의 전자수용체가 활용되며 이러한 인자는 산성 및 알칼리성 pH 또는 고온과 같은 극한 조건에서 가수분해 및 기타 형태의 불활성화에 취약하다. 이러한 문제점들을 해결하기 위해 Volker Sieber 연구팀은 thermophilic 조건 (~65°C)에서 호열성 효소 (thermophilic enzyme)의 활성을 안정적으로 스크리닝하기 위해, 미세액적 기반 대용량 효소 스크리닝을 시도하였다 (그림2). Error-prone PCR (epPCR)를 통해 준비된 glucose dehydrogenase variants와 thermostable 보조인자 carba-NADP+를 조합하여 효소활성 (catalytic activity)이 증가된 후보군을 스크리닝하였다. 이때, 기존의 효소활성 스크리닝 방법을, 미세액적 기반 효소활성 스크리닝 (high-throughput screening) 기법으로 대체하여 호열성 효소활성 스크리닝을 진행하였다. 결과적으로 단지 2nd 스크리닝 라운드에서 turnover number가 10배 증가된 호열성 효소 후보군 선정이 가능하였으며, 미세액적 기반 툴이 효소활성 스크리닝 플랫폼으로 효율적으로 사용 가능함을 시사하였다 [11].
맺음말
물리, 화학, 생명 등 다양한 분야에서 활용 가능하며, 단시간 및 저비용으로 대량 스크리닝이 가능한 미세액적 기반의 미세유체 시스템은 작은 크기의 칩 하나로 수행이 가능하여 큰 잠재력을 가지고 있다. 특히 본 고에서 소개한 미세액적 기반의 미세유체 시스템을 이용한 효소활성 스크리닝 기술은 캡슐화된 미세액적 효소에 짧은 열을 가하여 효소의 안정성을 높여 기존의 효소활성 스크리닝에서는 제한적이었던 호열성 효소활성을 스크리닝하였다. 이같이 미세액적 기반 미세유체 시스템은 효소공학 뿐 아니라 생체물질의 캡슐화, 단백질 결정, 입자 합성 및 약물개발 등의 분야에서도 활용 가능하다. 특히 약물개발을 위해서는 화합물 스크리닝, 세포 수준의 약물 테스트 등이 필요하며, 여러 실험과정들을 미세액적기반 미세유체 시스템을 활용하여 하나의 칩에서 효율적으로 이루어 낼 수 있다. 따라서 상기 플랫폼이 간단한 파이펫팅만으로 구동이 가능하도록 설계되고, 숙련된 연구원이 아니어도 사용가능한 접근성이 좋은 효율적인 시스템으로 발전될 것으로 기대된다.
참고문헌
1. W. N. Sharratt, V. E. Lee, R. D. Priestley, J. T. Cabral, Precision polymer particles by flash nanoprecipitation and microfluidic droplet extraction, ACS Appl. Polym. Mater., 3, 4746–4768, 2021.
2. S. Sohrabi, N. kassir, M. K. Moraveji, Droplet microfluidics: fundamentals and its advanced applications, RSC Adv., 10, 27560, 2020.
3. L. Shang, Y. Cheng, Y. Zhao, Emerging droplet microfluidics, Chem. Rev., 117, 7964-8040, 2017.
4. D. J. Collins et al., The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation, Lab. Chip., 15, 3439-3459, 2015.
5. A. C. Sun., et al., A droplet microfluidic platform for high-throughput photochemical reaction discovery, Nat. Comm., 11, 6202, 2020.
6. H. D. Xi., et al., Active droplet sorting in microfluidics: a review, Lab. Chip., 17, 751-771, 2017
7. F. Lan, B. Demaree, N. Ahmed, A. R. Abate, Single-cell genome sequencing at ultra-high-throughput with microfluidic droplet barcoding, Nat. Biotech., 35, 640-646, 2017
8. S. Sjostrom, et al. High-throughput screening for industrial enzyme production hosts by droplet microfludics. Lab. Chip., 14, 806-813, 2014
9. A. Jeremy., et al. Ultrahigh-throughput screening in drop-based microfluidics for directed evolution, Proc. Nati. Acad. Sci.,107, 4004-4009, 2010.
10. Z. Ioannis., et al., Hot Flows: Evolving an archaeal glucose dehydrogenase for ultrastable carba-NADP+ using microfluidics at elevated temperatures, ACS Catal.,12, 1841-1846, 2022.
11. F. Ma., et al. Efficient molecular evolution to generate enantioselective enzymes using a dual-channel microfluidic droplet screening platform, Nat. Comm., 9, 1030, 2018.
 JOIN
JOIN LOGIN
LOGIN
 Latest update
Latest update